- Säuren
Säuren. I. S. sind chemische Verbindungen, welche mit Basen Salze bilden u. dadurch ihm Eigenthümlichkeiten zum Theil od. ganz verlieren. Sie sind bei gewöhnlicher Temperatur theils gasförmig, theils flüssig, theils fest; viele S. enthalten chemisch gebundenes Wasser (basisches Wasser) u. geben dasselbe nur äußerst schwierig ab, lassen sich daher schwer wasserfrei darstellen; wenige sind stets wasserfrei. Sie sind theils in Wasser löslich, theils unlöslich; die in Wasser löslichen besitzen einen mehr od. weniger scharfsauren Geschmack u. röthen den blauen Lackmusfarbstoff. Der Grad der Acidität, d.h. der Eigenschaft als S. aufzutreten, ist bei den verschiedenen Säuren sehr verschieden; starke Säuren sind z.B. Schwefelsäure, Oxalsäure, Salpetersäure, Chromsäure, Phosphorsäure, Essigsäure; schwache S. sind z.B. Kohlensäure, Stearinsäure. Die stärkeren S. treiben die schwächeren aus ihren Salzen aus, doch ist dabei Temperatur u.a. Nebenumstände von Einfluß; so wird z.B. aus Lösungen von kieselsauren Salzen die Kieselsäure durch ziemlich schwache Säuren ausgetrieben, während sie in der Schmelzhitze eine der stärksten S. ist. Man unterscheidet zunächst unorganische S. (Mineralsäuren), deren Radical ein Metalloid od. Metall, u. organische S., deren Radical ein kohlenstoffhaltiger Atomcomplex ist. Die unorganischen S. sind entweder Oxyde der Metalloide u. Metalle, wie Schwefelsäure = SO3, schwefelige Säure = SO2, Kohlensäure = CO2, Salpetersäure = NO5; Untersalpetersäure = NO4, salpetrige Säure = NO3, Chlorsäure = ClO5, Phosphorsäure = PO5, Arsensäure = AsO5, Kieselsäure = SiO3 od. SiO2, Borsäure = BrO3, Chromsäure = CrO3, Antimonsäure = SbO5, Tellursäure = TeO3, Titansäure = TiO2, Molybdänsäure = MoO3, od. Wasserstoffverbindungen der Halogene, wie Chlorwasserstoffsäure = ClH, Bromwasserstoffsäure = BrH, Fluorwasserstoffsäure = FlH, s. unten. Sie finden sich in der Natur theils frei, theils u. meistens an Basen gebunden, im Mineralreich, sowie im Pflanzen- u. Thierorganismus; sie sind im Allgemeinen stärkere S., als die organischen. Die organischen S. kommen selten frei in der Natur vor; sie sind bes. im Pflanzenreich allgemein verbreitet (Pflanzensäuren), manche spielen jedenfalls eine wichtige Rolle in dem Proceß der Vegetation, so die Oxalsäure, welche vielleicht in keiner Pflanze fehlt; manche Pflanzensäuren sind nur einzelnen Pflanzenfamilien od. Gattungen eigenthümlich. Weniger zahlreich als die Pflanzensäuren sind die im Thierorganismus vorkommenden organischen S.; nur wenige S. finden sich in beiden Reichen. Eine große Anzahl organischer S. sind nur Kunstproducte, finden sich nirgends in der Natur. In der Wärme verflüchtigen sich viele organische S., andere zersetzen sich unter Abscheidung von Kohle; in ihren Verbindungen mit fixen Alkalien werden sie alle, mit Ausnahme der Oxalsäure, durch die Hitze zerlegt. Eine gewisse Klasse von organischen S. gibt beim Erhitzen ihrer Kalksalze eigenthümliche sauerstoffarme Körper, die Ketone (s.d.). Beim Erhitzen[11] complicirter, nicht flüchtiger organischer S. entstehen häufig sogenannte Pyrosäuren (Brenzsäuren, s.d.). Viele organische S. zersetzen sich unter dem Einfluß eines Ferments u. bei Gegenwart alkalischer Basen in Kohlensäure u. Wasser; ihre Alkalisalze werden in der Blutbahn in kohlensaure Salze verbrannt u. gehen als solche in den Harn über; andere erleiden im Thierkörper merkwürdige Veränderungen, wie die Benzoësäure, welche in Hippursäure übergeht. Viele organische S. liefern eigenthümliche S. durch Substitution, indem sie Untersalpetersäure, Chlor, Brom od. andere Radicale unter Abgabe äquivalenter Mengen von Wasserstoff in sich aufnehmen. Diese abgeleiteten S. sind oft der ursprünglichen Säure ganz analog, selbst in ihren Salzen u. Zersetzungsproducten. So bildet z.B. die Essigsäure C4H4O4 durch Aufnahme von Chlor gegen äquivalente Mengen Wasserstoff die Säuren: C4H3ClO4, C4H2Cl2O4, C4HCl3O4, welche trotz der verschiedenen Zusammensetzung einander höchst ähnlich sind. Häufig tritt Untersalpetersäure als substituirender Stoff auf, u. die dadurch gebildeten S. heißen Nitrosäuren (s.d.). Ihrer Constitution u. ihren chemischen Eigenschaften nach lassen sich die organischen S. in Gruppen abtheilen, welche bald mehr, bald weniger wissenschaftlich scharf begrenzt u. deren Glieder bald homolog, bald nur analog zusammengesetzt sind. Es lassen sich folgende Gruppen von organischen S. unterscheiden: a) Fettsäuregruppe (Lipogene S., Ameisensäuregruppe), einbasische S., deren generelle Formel CnHnO4 = CnHn-1O3 _. HO ist, s. Fette Säuren. b) Aromatische S. (Benzoësäuregruppe), einbasische S. von der Zusammensetzung CnHn–8O4 = CnHn– 9O3 . HO od. CnHn– 8O5 = CnHn–9O5 . HO. c) Oxalsäureruppe (Bernsteinsäuregruppe), zweibasische. S., CnHn–2 O8 = CnHn–4O6 . 2HO. d) Ölsäuregruppe, einbasische S., CnHn-2O4 = CnHn-3O3 . HO. e) Milchsäuregruppe, zweibasische S., CnHnO12 = CnHn–2O10 . 2HO. f) Stickstofffreie gepaarte S.; g) Stickstoffhaltige S. Den in der Natur nur sehr untergeordnet auftretenden stickstoffhaltigen S. schließt sich die überaus große Zahl der künstlich erzeugten an; zu diesen gehören die Amidsäuren (s. unten), die Nitrosäuren (s.d.), die sauren Cyanverbindungen u. endlich die S., in welchen ein neutraler od. basischer stickstoffhaltiger Paarling neben einem stickstofffreien Säureradical (Acidoyl) vorhanden ist; hierher gehören die mit Glycocoll gepaarten S.
II. Constitution der Säuren. Die S. wurden früher sämmtlich für Verbindungen eines Elements od. zusammengesetzten Radicals mit Sauerstoff gehalten; auch in den salzsauren, flußsauren etc. Verbindungen (Chlormetallen, Fluormetallen etc.) nahm man Sauerstoff an, indem man z.B. die in den Chlormetallen enthaltene Salzsäure als die Sauerstoffverbindung des Muriums, eines hypothetischen Radicals, betrachtete. Mit der richtigen Erkenntniß der Natur dieser Salze u. der Anerkennung von sogenannten salzbildenden Elementen ergaben sich zwei in ihrer Constitution wesentlich verschiedene Klassen von S.; man unterschied, wie auch gegenwärtig noch gewöhnlich, Wasserstoffsäuren u. Sauerstoffsäuren. Wasserstoffsäuren sind die Wasserstoffverbindungen der sogenannten salzbildenden Elemente, Chlor, Brom, Jod, Fluor, also ClH = Chlorwasserstoffsäure (Salzsäure), BrH = Bromwasserstoffsäure etc., denen sich die Cyanwasserstoffsäure = C2N . H u. Verwandte (Rhodanwasserstoffsäure.) anschließen. Diese S. bilden neutrale Salze, indem der Wasserstoff gegen Metall ausgetauscht wird; so entstehen die Haloidsalze, wie KCl, PbCl, NaBr, CaFe, KC2N etc.; die basischen u. sauren Salze müssen als Verbindungen von neutralen Salzen mit Metalloxyd, resp. mit Wasserstoffsäure angesehen werden, z.B. basisches Chlorblei = PbCl + PbO, saures Fluorkalium = KFe + HFe. Unorganische Sauerstoffsäuren sind hauptsächlich Oxyde der Metalloide, z.B. SO3, NO5, CO2, ClO5, doch existiren auch von den Metallen Sauerstoffverbindungen, welche alle Eigenschaften der S. besitzen, wie CrO3, od. doch andern Basen gegenüber die Rolle von S. spielen, wie SnO2. Manche Elemente bilden mit verschiedenen Äquivalentmengen Sauerstoff verschiedene S., so z.B. existiren vom Chlor fünf verschiedene S.: ClO = Unterchlorige Säure, ClO3 = chlorige Säure, ClO4 = Unterchlorsäure, ClO5 = Chlorsäure u. ClO7 = Überchlorsäure; vom Phosphor u. Stickstoff je drei S. : PO = unterphosphorige Säure, PO3 = phosphorige Säure u. PO5 = Phosphorsäure. NO3 = salpetrige Säure, NO4 = Untersalpetersäure u. NO3 = Salpetersäure. Die Analogie der Wasserstoffsäuren mit den Hydraten der Sauerstoffsäuren u. der Haloidsalze mit den Sauerstoffsalzen veranlaßte Davy u. Dumas zu der Annahme, daß alle S., unorganische wie organische, Wasserstoffsäuren seien, Verbindungen des Wasserstoffs mit einem Element od. einem zusammengesetzten Radical. Nach dieser, in neuerer Zeit bes. durch Liebig zur Geltung gebrachten Wasserstoffsäurentheorie (im Gegensatz zur Sauerstoffsäurentheorie, welche neben den Wasserstoffsäuren noch Sauerstoffsäuren annimmt), ist die Schwefelsäure nicht SO3 . HO, sondern SO4 . H, analog der Chlorwasserstoffsäure ClH u. der Cyanwasserstoffsäure C2N . H; Salpetersäure nicht NO5 . HO, sondern NO6 . H, Essigsäure nicht C4H3O3 . HO, sondern C4H3O4 . H. Dieser mit dem Radical verbundene, also außerhalb desselben gelegene Wasserstoff heißt basischer Wasserstoff u. kann durch Metalle od. Basyle vertreten werden, analog dem basischen Wasser nach der Sauerstoffsäurentheorie, an dessen Stelle das Oxyd eines Metalls od. Basyls treten kann. Wie also ZcCl aus HCl u. Zc entsteht, indem das Zc die Stelle des H einnimmt, so tritt bei der Bildung von schwefelsaurem Zinkoxyd das Zc an die Stelle des H in der Verbindung SO4 . H; die Formel dieses Salzes ist demnach SO4 . Zc. Diese Theorie schließt also die wasserfreien S. aus (s.u. Salze). Nach der von Gerhardt aufgestellten Typentheorie werden alle echten (sauerstofffreien) Wasserstoffsäuren auf den Typus ClH bezogen, z.B.: JH, O2H . H. die Sauerstoffsäuren auf den Typus H2O2 od. Vielfache, z.B.:
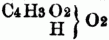
= Essigsäurehydrat,
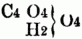
= Oxalsäurehydrat,
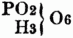
gewöhnliche Phosphorsäure. Die Bildung von Salzen erfolgt durch Eintritt von Metall od. Basyl an die Stelle des basischen Wafferstoffs.
III. Mehrbasische Säuren. Da die S. vom Typus H2O2 nur 1 Äquiv. basischen Wasserstoff[12] enthalten, so können sie nur 1 Äquiv. Metall od. Basyl aufnehmen, heißen daher einbasische S.; die nach dem Typus H4O4 mit 2 Äquiv. u. die nach dem Typus H6O6 mit 3 Äquiv. basischen Wasserstoff gebildeten S. sind die zwei- u. dreibasischen S.; jede Säure mit mehr als 1 Äquiv. basischen Wasserstoff heißt eine mehrbasische Säure. Den Grund zu der 1838 von Liebig ausführlich entwickelten Theorie der mehrbasischen S. gab die Untersuchung Grahams über die verschiedenen Modificationen der Phosphorsäure u. ihrer Salze. Nach der Sauerstoffsäurentheorie betrachtete man die drei Modificationen der Phosphorsäure als verschiedene Hydrate von PO5, u. zwar die gewöhnliche Phosphorsäure als PO5 (3HO) u. die daraus abgeleiteten drei Salze PO5 (RO, 2HO), PO5 (2RO, HO), PO5 (3RO), die Pyrophosphorsäure als PO5 (2HO) u. ihre 2 Salze PO5 (RO, HO), PO5 (2RO), endlich die Metaphosphorsäure PO5 (HO) mit ihrem einzigen Salz PO5 (RO). Ein tieferer Einblick in die Verschiedenheit der Phosphorsäuremodificationen war durch die Wasserstoffsäurentheorie gegeben; diese nahm in den drei verschiedenen Zuständen drei verschiedene sauerstoffhaltige Radicale an u. erklärte hieraus die bedeutende Verschiedenheit der drei Phosphorsäuren; hiernach ist also nicht PO5 + HO, sondern (nach Dulong) PO6 + H od. (nach Gerhardt)
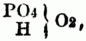
nicht PO5 + 2HO, sondern
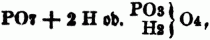
nicht PO5 + 3HO, sondern
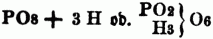
zu schreiben. Diese Theorie nimmt also in der freien Säure ungleiche Mengen basischen Wasserstoff an, welcher theilweis od. ganz durch Metall od. Basyl vertreten werden kann; die phosphorsauren Salze sind daher zu schreiben: PO6 (R), PO7 (H, R), PO7 (2 R), PO8 (2H, R), PO8 (H, 2R), PO8 (3R), od.:
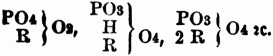
Liebig fand, daß außer der Phosphorsäure auch andere, namentlich manche organische S., auf 1 Atom 1 od. 2, ed. auch 1, 2 od. 3 Atome Basis aufzunehmen im Stande seien. Die zuerst als solche anerkannte mehrbasische organische Säure ist die Citronensäure. Die empirische Formel der getrockneten freien Citronensäure ist C6H4O7 od. C12H8O14, die des citronensauren Bleioxyds, welches durch Fällen von überschüssigem essigsaurem Bleioxyd mit Citronensäure erhalten wird, C4H2PbO5 od. C12H6Pb3O15. Schreibt man nach der Sauerstoffsäurentheorie die Formel des Bleisalzes C4H2O4PbO, so erhält man für die freie Säure die wenig wahrscheinliche Formel 3C4H2O4 . 2HO. Daß dies die wahre Formel für die Citronensäure nicht ist, geht daraus hervor, daß das Silbersalz die Zusammensetzung C12H5Ag3O14 hat, u. da diese Formel durch 3 nicht dividirt werden kann, so muß man die getrocknete freie Citronensäure C12H8O14 schreiben u. als eine dreibasische Säure betrachten; nach der Sauerstoffsäurentheorie ist ihre Formel demnach C12H5O11 . 3HO, wo 1, 2 od. alle 3 Äquiv. basisches Wasser durch Metalloxyd vertretbar sind, so daß diese Säure drei verschiedene Salze bildet; nach der Wasserstoffsäurentheorie ist ihre Formel
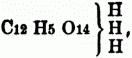
wo H durch Metall od. Basyl ersetzt werden kann. Unter normalen Salzen ein- od. mehrbasischer S. versteht man diejenigen, in welchen alles basische Wasser (in den Formeln nach der Sauerstoffsäurentheorie) durch Basis vertreten ist. Die normalen Kalisalze der 3 Säuren: Essigsäure (einbasisch) = C4H3O3 (HO), der Weinsäure (zweibasisch) = C8H4O10 (HO, HO) u. der Citronensäure (dreibasisch) = C12H5O11 (HO, HO, HO), sind: Normales essigsaures Kali = C4H3O3 (KO), normales weinsaures Kali = C8H4O10 (KO, KO) u. normales citronensaures Kali = C12H5O11 (KO, KO, KO). In den sauren Salzen einbasischer S. ist mit dem normalen Salz noch freie Säure verbunden, in den sauren Salzen mehrbasischer S. ist nicht alles basische Wasser durch Basis ersetzt; daher kann eine zweibasische Säure ein saures Salz, eine dreibasische zwei saure Salze bilden, z.B.: saures essigsaures Kali = C4H3O3 . (KO) + C4H3O3 . (HO), saures weinsaures Kali = C8H4O10 (HO, KO), saures citronensaures Kali = C12H5O11 (HO, HO, KO) u. C12H5O11 (HO, KO, KO). Die basischen Salze aller S. enthalten mit dem normalen Salz noch Basis verbunden, z.B.: basisch essigsaures Bleioxyd = C4H3O3 (PbO) + xPbO, basisch weinsaures Bleioxyd = C8H4O10 (PbO, PbO) + xPbO, basisch citronensaures Bleioxyd = C12H5O11 (PbO, PbO, PbO) + xPbO. Als hauptsächliches Kennzeichen mehrbasischer S. galt früher nur die Unmöglichkeit die Formeln der Salze so zu theilen, daß in ihnen auf 1 Äquival. Säure 1 Äquiv. Basis kommt; so kann die Citronensäure, welche Salze von der Formel C12H5O11 . 3 RO bildet, nicht als einbasisch betrachtet werden, weil C12H5O11 durch 3 nicht getheilt werden kann, ohne daß sich Bruchtheile von Atomen ergäben, d.h. weil sich diese Salze nicht so schreiben lassen, daß auf 1 Äquiv. Säure 1 Äquiv. Basis kommt; dasselbe gilt von der Phosphorsäure. Als ein weiterer Anhaltepunkt zur Entscheidung, ob eine Säure mit mehr Wahrscheinlichkeit ein- od. mehrbasisch ist dient die Erkenntniß, daß in einem Atom aller organischen Verbindungen immer eine gerade Anzahl Kohlenstoffatome enthalten ist; daher gibt man der Pyroweinsäure nicht die Formel C5H3O3 . HO, sondern C10H6O6 . 2HO, betrachtet sie also als zweibasisch. Die organischen ein- u. mehrbasischen Säuren weichen in mehren Punkten wesentlich von einander ab, wodurch die Beurtheilung, ob eine Säure ein- od. mehrbasisch ist, wesentlich erleichtert wird; doch ist die Unsicherheit in der Erkennung der ein- u. mehrbasischen S. noch nicht vollständig beseitigt, weil sie nicht alle bei jeder als mehrbasisch betrachteten Säure zusammentreffen u. weil sie nicht von sämmtlichen Chemikern als absolut entscheidend angesehen werden. Die Hydrate der zweibasischen S. gehen erhitzt unter Wasserverlust in Anhydrit (wasserfreie Säure) über, z.B.: Weinsäure, C8H4O10 . 2HO, liefert beim Erhitzen Weinsäureanhydrid = C8H4O10, die einbasischen S. geben auf diese Weise keine Anhydride; über Anhydride s. unt. VI Einbasische S. bilden durch Elimination von 2 Äquiv. Wasser aus ihren normalen Ammoniaksalzen nur neutrale Amidverbindungen, z.B.: C4H3O3 . H4NO (essigsaures Ammoniak) –[13] 2HO = C4H5NO2 (Acetamid), zweibasische S. geben durch Verlust von 2 Äquiv. Wasser aus dem sauren Ammoniaksalz eine saure Amidverbindung (einbasische Aminsäuren), z.B.: C8H7O10, HO, H4NO (saures weinsaures Ammoniak), – 2HO = C8H6 NO9, HO (Tartraminsäure), durch Austreten von 4 Äquiv. Wasser aus dem normalen Ammoniaksalz eine neutrale Amidverbindung, z.B.: C8H4O10 . 2H4NO (neutrales weinsaures Ammoniak). – 4HO = C8H8N2O8 (Tartramid). Die dreibasischen S. bilden zwei Aminsäuren, eine zweibasische u. eine einbasische, u. eine neutrale Amidverbindung. Bei der Einwirkung auf Alkohole liefern die einbasischen S. unter Wasserverlust nur neutrale Äther, zweibasische S. einen neutralen Äther u. eine einbasische Äthersäure, dreibasische S. einen neutralen Äther, eine einbasische u. eine zweibasische Äthersäure. Die neutralen Äther der zweibasischen S. entsprechen 2 Vol. Dampf, während die der einbasischen S. 4 Vol. Dampf bilden; schreibt man daher beide so, daß die durch die Formel ausgedrückte Menge 4 Vol. Dampf entspricht, so ist in dem Äther der zweibasischen Säure doppelt so viel Äthyl enthalten, als in dem der einbasischen Säure. Bei der trockenen Destillation mit alkalischen Erden verlieren die einbasischen S. 2 Atome Kohlensäure, wodurch entweder ein reiner Kohlenwasserstoff od., wenn die Säure mehr als 4 Atome O enthält, eine sauerstoffarme saure Kohlenwasserstoffverbindung entsteht; zweibasische S. geben bei der trockenen Destillation für sich od. auch mit alkalischen Erden unter Verlust von 2 Atomen Kohlensäure häufig einbasische S. od. unter Verlust von 4 Atomen Kohlensäure Kohlenwasserstoff od. sauerstoffarme Kohlenwasserstoffverbindungen. Die dreibasischen S. liefern zwei- od. einbasische S. Zu den einbasischen organischen S. gehören z.B. die S. der Fettsäure- u. Ölsäuregruppe, die aromatischen S.; zweibasisch sind die S. der Oxalsäure- u. Milchsäuregruppe, dreibasisch sind Aconit-, Citron-, Mecon- u. Cyanursäure.
IV. Gepaarte Säuren. Mehre organische S. sind mit Sicherheit als gepaarte Verbindungen (s.d.) erkannt worden, in denen der Paarling (s.d.) im Körper der verschiedensten Art oft eine Säure selbst ist. Zu den eigentlichen gepaarten organischen S. gehört die von Liebig zuerst als solche erkannte Mandelsäure, welche als gepaart aus Benzoylwasserstoff u. Ameisensäure anzusehen ist; die Amygdalinsäure, in welcher Benzoylwasserstoff neben Zucker mit Ameisensäure; Caincasäure, in welcher Terpentinöl mit Zucker u. Ameisensäure gepaart ist; wahrscheinlich sind die Gerbsäuren mit Zucker gepaarte S. Zu diesen gepaarten S. gehören diejenigen sauer reagirenden u. basensättigenden Verbindungen nicht, welche aus der Vereinigung einer Säure mit einem organischen Oxyd hervorgehen, wobei aber die Hälfte der Sättigungscapacität der Säure verloren gegangen ist; solche Verbindungen, wie die Ätherschwefelsäure, sind keine S., sondern saure Salze. Die durch die Einwirkung von Salpetersäure auf viele organische Substanzen gebildeten Nitrosäuren wurden früher für gepaarte Salpetersäuren angesehen; die Constitution dieser S. läßt sich aber nicht nach der Theorie der Paarung, sondern durch Substitution erklären. Kolbe versuchte die Lehre von der chemischen Paarung zur Erklärung der Constitution auch anderer S. anzuwenden; so betrachtete er z.B. die Essigsäure als Methyloxalsäure, Buttersäure als Propyloxalsäure etc. (s. Gepaarte Verbindungen), doch können solche S. nicht zu den gepaarten S. gerechnet werden, da ihre gepaarte Natur noch keineswegs mit Sicherheit dargethan ist.
V. Amidsäuren (Aminsäuren) u. Amidosäuren sind abgeleitete stickstoffhaltige organische S. Die Amidsäuren entstehen aus den sauren Ammoniaksalzen zwei- u. dreibasischer S. durch Elimination von Wasser; die zweibasischen S. bilden eine einbasische Amidsäure, die dreibasischen eine einbasische u. eine zweibasische. Nur die Amidsäuren der zweibasischen S. sind näher bekannt; es sind S. vom gemischten Typus H3N + H2O2 od. besser vom einfachen Typus
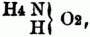
welche an der Stelle von 2 Äquiv. Wasserstoff im Ammoniak, resp. im Ammonium, ein zweiatomiges Säureradical (Acydoyt) enthalten. Z.B. aus dem sauren oxalsauren Ammoniak = C4O6 . HO, H4NO entsteht durch Austritt von 2 Äquiv. Wasser C4H3NO6 = Oxamidsäure, welche das zweiatomige Acidoyl C4O4 (Oxaloyl) enthält; ihre Formel ist demnach zu schreiben
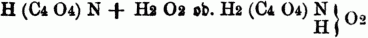
Außer dem die 2 Äquiv. Wasserstoff vertretenden zweiatomigen Acidoyl können diese S. noch 1 Äqu. Wasserstoff gegen ein einatomiges Acidoyl vertauschen; diese S. haben dann die allgemeine Formel:
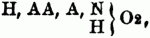
wo AA ein zweiatomiges, A ein einatomiges Acidoyl bedeutet, z.B.:
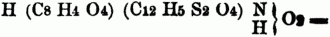
Succinosulphenylamidsäure. Die Amidsäuren der zweibasischen S. enthalten nur 1 Äquiv. typischen Wasserstoff; wird derselbe durch Metall ersetzt, so entstehen die halborganischen Salze, tritt an seine Stelle Alkoholradical, so entstehen die Äthersalze der Amidsäuren; die letzteren heißen auch Amethane. Oxamidsaures Kali ist demnach
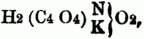
oxamidsaures Äthyloxyd (Äthyloxamethan)
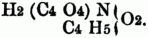
Die Amidsäuren sind gewöhnlich fest, farblos od. gelblich u. gehen leicht durch Aufnahme von Wasser in das saure Ammoniaksalz über; man erhält sie bei der trockenen Destillation der sauren Ammoniaksalze, durch Einleiten von Ammoniakgas in die alkoholische Lösung der Anhydrite, wobei sich ein Ammoniaksalz der Amidsäure bildet, ferner durch Kochen der Imide mit schwachem wässerigem Ammoniak. Eine besondere Klasse der Amidsäuren bilden die Alkylamidsäuren, in denen das typische Wasserstoffatom beibehalten, während neben dem zweiatomigen Acidoyl noch ein drittes Äquiv, Wasserstoff des Ammoniums durch Alkoholradical substituirt ist, z.B.:
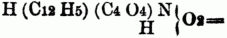
Phenyloxamidsäure. Amidosäuren sind den Amiden ähnliche Verbindungen; es sind S. vom Typus H2O2, in welchen 1 Äquival. Wasserstoff durch 1 Äquiv. eines amidirten einatomigen Acidoyls vertreten ist; so ist die von der Essigsäure abgeleitete Amidosäure

Amidoessigsäure[14] (Glycocoll). Diese Körper, von denen bis jetzt nur wenige bekannt sind, sind krystallinisch, farblos, schwach sauer od. neutral u. verbinden sich sowohl mit Basen als auch mit S., sowie auch mit Salzen, daher sie bald für S., bald für Basen gehalten wurden; am nächsten stehen sie den Monamiden. Man erhält diese S. künstlich, indem man die entsprechenden Nitrosäuren durch Schwefelwasserstoff reducirt od. Ammoniak auf die Chlor-, Brom- od. Iodsubstitute der einbasischen S. einwirken läßt; einzelne hierher gehörige Körper lassen sich auf besondere Weise gewinnen. Oxysäuren sind Abkömmlinge der Amidosäuren, welche sich bei der Einwirkung von salpetriger Säure auf diese bilden; so entsteht aus Amidobenzoesäure (Benzaminsäure) die Orybenzoësäure.
VI. Anhydride (Wasserfreie S.). Nach der Sauerstoffsäurentheorie können die freien S. nicht ohne Wasser bestehen, durch Verlust desselben büßen sie ihre wesentlichen Eigenschaften ein, sie sind dann keine S. mehr u. heißen Anhydride; so entsteht aus der Oxalsäure C4O6 . 2HO das Oxalsäureanhydrid C4O6. Gerhardt betrachtet die Anhydride als S., deren basischer Wasserstoff durch Acidoyl ersetzt ist, u. zwar entweder durch dasselbe, welches die Säure enthält, wodurch die gleichartigen, od. durch ein anderes, wodurch die ungleichartigen Anhydride entstehen, z.B.:
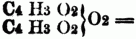
Essiganhydrid,
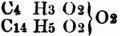
= Essigbenzoëanhydrid. Die Anhydride der einbasischen S. wurden von Gerhardt 1852 entdeckt; sie entstehen bei der Einwirkung der Chloride der Säurenradicale auf die Salze der fetten S., z.B.: C14H5O4Na (benzoësaures Natron) + C14H5
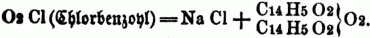
Die Anhydride der zweibasischen S. sind schon längst bekannt; sie entstehen durch bloßes Erhitzen der Säurehydrate; ihre Formeln werden daher nicht verdoppelt, wie die der Anhydride einbasischer S., sondern sie gehören ebenfalls dem Typus H2O2 an, in welchem beide Atome Wasserstoff durch das zweiatomige Säureradical ersetzt sind, z.B.: C4O4}O2 = Oxalsäureanhydrid.
Pierer's Lexicon. 1857–1865.
