- Organische Chemie
Organische Chemie, ein Zweig der allgemeinen Chemie, welcher das Studium der organischen Körper umfaßt. Die Begriffsbestimmung der organischen Körper glaubte man früher von ihrer Entstehungsweise ableiten zu müssen u. betrachtete dieselben als Substanzen, welche ausschließlich unter dem Einfluß der Lebensthätigkeit in dem pflanzlichen u. thierischen Organismus gebildet werden u. nicht künstlich darstellbar seien, wogegen die unorganischen Verbindungen in der unbelebten Natur auftreten u. durch künstliche Mittel erzeugt werden könnten. Obgleich bis jetzt noch die meisten der organischen Verbindungen nicht künstlich aus unorganischen Körpern hergestellt werden können, so kann doch die Abstammung u. Entstehung eines Körpers jetzt um so weniger maßgebend für die Unterscheidung von organischen u. unorganischen Körpern sein, als nicht nur der thierische u. pflanzliche Organismus unorganische Verbindungen erzeugt, sondern auch neuerdings große Gruppen entschieden organischer Körper aus rein unorganischem Material hervorgebracht worden sind. Dagegen bietet die Betrachtung der elementaren Zusammensetzung ein Mittel zur Unterscheidung organischer Körper von unorganischen. Aus diesem Gesichtspunkt bezeichnet man die organischen Körper als Verbindungen, die in einem Atom 2 od. mehr Atome Kohlenstoff enthalten. Fast in allen organischen Verbindungen ist neben Kohlenstoff noch Wasserstoff, in sehr vielen auch Sauerstoff, in vielen Stickstoff enthalten; seltener kommen Schwefel u. Phosphor vor. Aus dieser kleinen Anzahl von Elementen setzt sich die unermeßliche Menge von organischen Verbindungen zusammen, indem sich diese Elemente nach den verschiedenartigsten Verhältnissen vereinigen, während die unorganischen Verbindungen aus sehr vielen Elementen, aber nach nur wenigen u. sehr einfachen Verhältnissen, gebildet sind. In den künstlich erzeugten od. abgeänderten organischen Körpern kann jedes Element auftreten, nur darf daneben der Gehalt von mindestens 2 Atomen Kohlenstoff nicht fehlen. Die organischen Verbindungen enthalten nie so viel Sauerstoff, daß der Kohlenstoff derselben zu Kohlensäure u. der Wasserstoff zu Wasser verbrannt werden könnte, daher verkohlen alle organischen Verbindungen, selbst die flüchtigsten, beim Erhitzen in geeigneten Apparaten; sie sind alle verbrennlich u. im Wesentlichen nach einer Methode analysirbar, nämlich nach der Verbrennungsanalyse. Der Stickstoff findet sich in ihnen nach der Menge von 1 bis höchstens 6 Atomen, meist enthalten die organischen Körper nur 1 bis 2 Atome Stickstoff. Im Allgemeinen haben die organischen Verbindungen hohe Atomzahlen u. bilden häufig sehr zusammengesetzte Atomcomplexe, daher sie auch eine große Mannigfaltigkeit in den Zersetzungsweisen u. Zersetzungsproducten darbieten.
Früher glaubte man, die organischen Körper seien unmittelbare Combinationen von Kohlenstoff, Wasserstoff, Stickstoff u. Sauerstoff, u. die Mannigfaltigkeit in ihnen sei allein bedingt durch verschiedene. Mengenverhältnisse, in denen sich diese Atome verbinden; erst gegen Ende des 18. Jahrh. fing man an, eine gewisse Gruppirung der Atome zu näheren Bestandtheilen in den organischen Verbindungen anzunehmen; die Vorstellungen über diese Gruppirung u. die Art u. Weise der Zusammensetzung aus näheren Bestandtheilen, d.h. die Lehre von der Constitution der organischen Körper, ist für die O. Ch. von der größten Wichtigkeit, weil es sich hierbei zugleich darum handelt, die Mittel u. Wege kennen zu lernen, welche die Natur bei der Bildung dieser organischen Atomcomplexe eingeschlagen hat, u. die Methoden zur künstlichen Erzeugung (Synthese) organischer Körper ausfindig zu machen. Anfänglich glaubte man, alle organischen Verbindungen seien Verbindungen von einfachen unorganischen Verbindungen, wie Kohlensäure, Kohlenoxyd, Wasser, Ölbildendem Gas u. Sumpfgas; so sah Gay-Lussac den Alkohol an als eine Verbindung von 2CH mit 2HO. Allein durch solche Annahmen ist der Willkür der größte Spielraum gegeben u. die Kenntniß der Constitution organischer Verbindungen dadurch nicht gefördert worden. In der neueren Zeit sind folgende Theorien zur Erklärung der Constitution organischer Körper aufgestellt worden: A) Theorie der zusammengesetzten Radicale. Nachdem Berzelius das Gesetz der bestimmten Proportionen auch für die organischen Körper nachgewiesen u. gezeigt hatte, daß viele organische sauerstoffhaltige Körper sich mit unorganischen Oxyden in bestimmten Verhältnissen verbinden, so lag die Ansicht nahe, die sauerstoffhaltigen organischen Verbindungen ebenfalls als Oxyde zu betrachten, deren Radicale aber zusammengesetzt sind, während die unorganischen Körper einfache Radicaleenthalten. Man nannte deshalb auch die O. Ch. die Chemie der zusammengesetzten Radicale. Zusammengesetzte Radicale sind demnach organische Atomcomplexe, welche in einer Reihe von Verbindungen als nähere Bestandtheile angenommen sind u. die Rolle von Elementen inanalogen unorganischen Verbindungen spielen; die zusammengesetzten Radicale sind also die Elemente der O-n Ch. Wie sich das unorganische Element Kalium mit Sauerstoff zu Kali verbindet, so verbindet sich das organische Radical Äthyl (C4H = Ae) mit Sauerstoff zu Äther; wie ferner Kali mit Wasser Kalihydrat liefert, so gibt Äther in Verbindung mit Wasser Alkohol etc., sodaß man für das vorliegende Beispiel folgende zwei analoge Reihen erhält: Äthyl = Ae entspricht K; Äther = AeO entspr. KO; Alkohol = AeOHO entspr. KO, HO; Salzsäureäther = AeCl entspr. KCl; Salpetersäureäther – AeO, NO5 entspr. KO, NO5; Ätherschwefelsäure = AeO, 2SO3 + HO entspr. KO, 2SO3 + HO. So liefert Cyan (C2N) eine Verbindung mit Wasserstoff, welche der Salzsäure (ClH) ganz analog ist, mit Sauerstoff Sauerstoffsäuren, mit Metallen Salze, ganz entsprechend den Chlor- u. Brommetallen. Die zusammengesetzten Radicale sind theils binär, bestehen aus Kohlenstoff u. Wasserstoff od. aus Kohlenstoff u. Stickstoff; theils ternär u. quaternär; durch Substitution u. Paarung (s. unt. D) entstehen neue, substituirte u. gepaarte Radicale aus[348] ihnen. Nach ihrer Zusammensetzung erhalten sie verschiedene Benennungen; nach Berzeliuss Vorgange erhalten alle aus Kohlenstoff u. Wasserstoff, sowie die aus Kohlenstoff, Wasserstoff u. Sauerstoff die Endung yl; Schloßberger unterscheidet die binären (kohlenstoff- u. wasserstoffhaltige) Radicale durch die Endung yl von den sauerstoffhaltigen, welche die Endung oyl erhalten, so z.B. C14H5 = Benzyl, C14H5O2 = Benzoyl; die kohlenstoff- u. stickstoffhaltigen Radicale haben die Endung an, z.B. C2N = Cyan, C2NS2 = Rhodan. Für die aus Kohlenstoff, Wasserstoff u. Stickstoff bestehenden Radicale hat Berzelius die Endung ēn vorgeschlagen, indessen haben auch mehre Kohlenwasserstoffe (Amylen, Äthylen, Methylen) diese Endsylbe erhalten. Radicale, welche mit Sauerstoff Basen bilden, nennt man Basyle; dagegen Halyle, welche mit Sauerstoff Säuren bilden u. mit Metallen od. Wasserstoff in der Art der unorganischen Halogene sich verbinden. B) Substitutionstheorie u. Theorie der Dumas'schen Typen (Metalepsie). Gay-Lussac fand, daß, wenn man Wachs der Einwirkung von Chlor aussetzt, dieses Gas absorbirt u. dafür ein gleiches Volumen Chlorwasserstoffgas ausgeschieden wird. Dumas wiederholte später diesen Versuch mit Terpentinöl u. erhielt ein gleiches Resultat. Seitdem ist die Einwirkung des Chlors u.a. Salzbildner auf viele andere organische Verbindungen untersucht worden, u. es hat sich gefunden, daß häufig der organischen Verbindung ein Theil od. aller Wasserstoff entzogen u. z.B. durch Chlor, Brom, Jod, Untersalpetersäure etc. in entsprechenden Verhältnissen ersetzt (substituirt) werden könne, ohne daß bei dieser Vertauschung eine wesentliche Änderung in den chemischen Eigenschaften eintritt; selbst die Zersetzungsproducte dieser substituirten Verbindungen sind häufig ganz analog denen der ursprünglichen Substanz. So entsteht bei der Einwirkung von Chlorgas auf die Essigsäure (C4H4O) die Chloressigsäure (C4HCl3O4), indem 3 H durch 3Cl substituirt werden; die Chloressigsäure verhält sich aber ganz ähnlich der Essigsäure, hat dieselbe Sättigungscapacität u. liefert analoge Zersetzungsproducte. Aus dem Benzol (C12H6) entsteht durch Erwärmen mit rauchender Salpetersäure Nitrobenzol = C12H5NO4, in welchem also 1 Atom Wasserstoff durch 1 Atom NO4 ersetzt ist; durch Kochen mit rauchender Salpetersäure wird ein zweites Atom H durch NO4 ersetzt, es entsteht C12H42(NO4). Dumas nimmt nun an, daß die organischen Verbindungen aus einer Reihe von ursprünglichen Gruppen von Grundstoffen, sogenannten Typen, bestehen, aus denen jedes Element (mit Ausnahme des Kohlenstoffs) heraustreten u. durch ein anderes od. durch gewisse Verbindungen ersetzt werden kann, ohne daß die wesentlichen Eigenschaften der Gesammtgruppe dadurch umgeändert würden. Tritt aus einem Typus ein Element heraus, ohne daß dasselbe durch ein anderes Element ersetzt wird, so entsteht ein neuer mechanischer Typus (Moleculartypus). Wird dagegen der entzogene Bestandtheil äquivalentweise durch einen andern Körper ersetzt, so bleibt sein Molecül unverändert; die Glieder dieses chemischen Typus, mit der gleichen Zahl u. Anordnung der Atome, stimmen in den Haupteigenschaften überein u. zeigen nur insofern kleine Differenzen, als sie verschiedene Elemente führen. C) Kerntheorie von Laurent. Nach Laurent lassen sich alle organischen Verbindungen auf gewisse Atomgruppen zurückführen, welche aus Kohlenstoff u. Wasserstoff bestehen, aber nicht identisch sind mit den binären, aus Kohlenstoff u. Wasserstoff bestehenden Radicalen. Diese binären Atomgruppen heißen Stammkerne (Urkerne, Noyaux fontamentaux) u. aus diesen entstehen durch Substitution die abgeleiteten Kerne (Noyaux dérivés); so sind z.B. C4H3Cl u. C4H2Cl Ableitungen von dem Stammkern C4H4; außerdem lagern sich an die Stammkerne u. an die abgeleiteten Kerne häufig andere einfache od. zusammengesetzte Stoffe, welche aber nicht in den Atomcomplex des Kerns eingehen u. durch Reagentien nachweisbar sind. Die Kerne denkt man sich von einer bestimmten mathematischen Figur, z.B.:

Ein Stammkern od. ein abgeleiteter Kern kann 2, 4, 6 Atome Sauerstoff aufnehmen; durch Aufnahme von 2 Atomen Sauerstoff verwandelt er sich in ein neutrales Oxyd, so entsteht: C4H4 + 2O Aldehyd, C14H6 + 2 O Bittermandelöl; durch Hinzutreten von 4 O zum Kern entsteht eine einbasische Säure, z.B. C4H4 + 4O Essigsäure, C14H6 + 4O Benzoësäure; wenn sich endlich 6 O an einen Kern anlagern, so entsteht eine zweibasische Säure, z.B. C4H2O2 + 6O Oxalsäure. D) Lehre von der chemischen Paarung. Unterchemischer Paarung verstand man Anfangs die Vereinigung von gewissen chemisch wirksamen Oxyden (bes. Schwefelsäure) mit andern zusammengesetzten Körpern, ohne daß das Oxyd gesättigt wird, sondern seine Haupteigenschaften beibehält. Ist das Oxyd eine Säure, so verbindet es sich nach wie vor mit Basen, ohne daß der mit ihr gepaarte Körper dabei austritt; er ändert zwar die Eigenschaften des Oxyds mannigfach, läßt jedoch den Hauptcharakter desselben ungeändert u. heißt der Paarling (Copula). Nach u. nach dehnte sich der Begriff der Paarung immer mehr aus u. namentlich auf die immer zahlreicheren Fälle von Verbindungen functionell ähnlicher Substanzen, also von Säuren mit Säuren, indifferenten Körpern unter einander etc. Später zeigte sich, daß bei dem Zusammentreten zweier Körper zu einer gepaarten Verbindung Wasser austritt, wogegen beim Auseinanderfallen dieser Paarung (Entpaarung) ebensoviel Wasseratome aufgenommen werden. Nach der Theorie der Paarung stellt man sich z.B. die Chloressigsäure SO2Cl vor als 2 SO3 + SCl3, d.h. eine gepaarte Verbindung von Schwefelsäure u. Chlorschwefel; ferner die Essigsäure als C2O3 (Oxalsäure) C2H3 (Methyl) + HO; die Chloressigsäure als C2O3 (Oxalsäure) + C2Cl3 (Kohlenchlorid) + HO. Auch Paarungen höheren Grades gibt es, so ist z.B. das Amygdalin = C40H27NO22 = C14H6O2 (Benzoylwasserstoff) + 2C12H12O12 (2 Atome Traubenzucker) + C2H2O4 (Ameisensäurehydrat) + H3N (Ammoniak) – 8 HO. Berzelius hat die Theorie der Paarung namentlich auf die organischen Basen angewendet, in denen Ammoniak mit andern zusammengesetzten Körpern verbunden ist, so daß z.B. Harnstosk C2H4N2O2 = H3N (Ammoniak) = C2HNO2[349] (Urenoxyd) wäre Vgl. Gepaarte Verbindungen. E) Theorie der Homologen. Für die Feststellung der Formeln organischer Körper ist die Beziehung zwischen ihrer Zusammensetzung u. den physikalischen Eigenschaften von großer Wichtigkeit. So lassen sich viele organische Verbindungen von analoger Zusammensetzung zu Reihen vereinigen, deren Glieder auch correspondirende Eigenschaften besitzen. Alle bekannten Homologien zeigen die Übereinstimmung, daß die Glieder einer solchen Reihe stets nur um x . C2H2 differiren. Nach Kolbe erzeugt ein Kohlenwasserstoff C2H2 durch seine verschiedenen Verbindungen die homologen Reihen; so kann z.B. Methyl C2H3 als die Wasserstoffverbindung jenes Kohlenwasserstoffes, Äthyl C4H5 als 2C2H2 + H betrachtet werden; ebenso könnte sich C2H2 mit C2O3 . HO verbinden, u. in ähnlicher Weise, wie bei den ersteren Beispielen, wäre dann die Entstehung der homologen Säurereihe CnHn-1 O3 . HO gegeben. Homologe Reihen sind z.B.:
Ameisensäure = C2 H2 O4, siedet bei 99° Essigsäure = C4 H4 O4, siedet bei 118° Propionsäure = C6 H6 O4, siedet bei 137° Buttersäure = C8 H8 O4, siedet bei 156° Baldriansäure = C10 H10 O4, siedet bei 175° hier kommt also auf die Differenz von C2H2 eine Differenz von 19° im Siedepunkt. Holzgeist = C2H4O2, Weingeist = C4H6O2, Propylalkohol = C6H8O2, Butylalkohol = C8H10O2, Amylalkohol = C10H12O2, Äthal = C32H34O2; vgl. Homologie. F) Regel von der paaren Atomzahl. Alle organischen Verbindungen enthalten nur gerade Anzahlen Kohlenstoffatome; die Summe der Atome des Wasserstoffs, der Halogene, der Metalle u. der den Wasserstoff substituirenden Atomgruppen beträgt ebenfalls eine gerade Zahl; ebenso ist endlich die Summe der Sauerstoffatome od. der an seiner Stelle vorhandenen Schwefel-, Selen- u. Telluratome eine gerade Zahl. Diese Regeln haben durch die neuerdings beobachtete Gesetzmäßigkeit in den physikalischen Eigenschaften, bes. in der Dampfdichte u. dem Siedepunkt, Bestätigung gefunden u. eine Verdoppelung vieler Formeln mit ungeraden Atomzahlen nothwendig gemacht. G) Die neure Typentheorie von Gerhardt bezieht alle organischen, sowie auch alle unorganischen Verbindungen auf die drei Musterformeln od. Typen: Wasser, Wasserstoff u. Ammoniak:
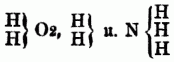
od. deren Vielfaches, z.B. H4O4, auf welche alle übrigen Verbindungen durch folgende Annahmen zurückgeführt werden können: a) in den Typen kann der Wasserstoff ganz od. zum Theil vertreten werden durch andere Elemente, sowie durch ganze Atomgruppen; b) der Sauerstoff in dem Typus H2O2 ist ersetzbar durch Schwefel u. analoge Körper; c) der Stickstoff im Typus H3N kann vertreten werden durch Phosphor, Arsen, Antimon u.a. Körper. So lassen sich von den drei Typen u. ihren Vielfachen folgende Verbindungen ableiten:
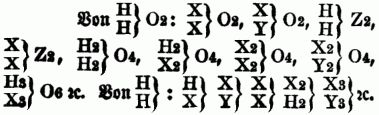
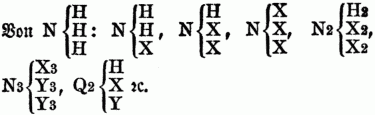
Für gewisse Verbindungen ist es nothwendig, die Paarung zweier Typen anzunehmen, z.B.: HH + H2O2, NH3 + H2O2, wodurch dann die gepaarten od. gemischten Typen entstehen. Unter dem Typus Wasser lassen sich demnach beispielsweise folgende Substanzen vereinigen:
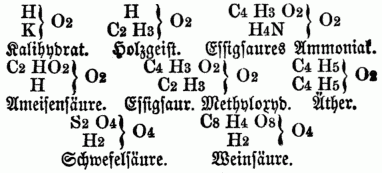
Unter dem Typus Wasserstoff:
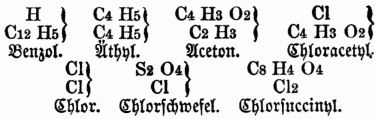
Die Ableitungen vom Typus Ammoniak s.u. Organische Basen. Von großer Bedeutung für die O. Ch. ist endlich die Gesetzmäßigkeit in den Beziehungen zwischen der Constitution u. den physikalischen. Eigenschaften, namentlich zwischen Zusammensetzung u. specifischem Gewicht, sowie zwischen Zusammensetzung u. Siedepunkt, wie sie namentlich von H. Kopp festgestellt worden sind, u. welche man unter dem Namen der physikalischen Stöchiometrie (vgl. Stöchiometrie) zusammenfaßt.
Pierer's Lexicon. 1857–1865.
