- Quecksilber
Quecksilber (Hydrargyrum, Mercurius, Argentum vivum), chemisches Zeichen Hg,☿, Atomgewicht = 100 (H = 1), 1250 (O = 100). Das Q. ist das einzige bei gewöhnlicher Temperatur flüssige Metall, es ist silberweiß mit einem Stich ins Blaue, ausgezeichnet metallglänzend; sein specifisches Gewicht ist nach Kupffer bei + 4° C. 13,5886, nach Regnault bei 0° C. 13,5959 es leitet die Wärme gut u. besitzt eine geringe Wärmecapacität; nach Kopp ist dieselbe 0,0332. Die Ausdehnung des Q-s beim Erwärmen von 0–100° C. ist fast gleichförmig, der Ausdehnungscoefficient ist bei 0° 0,00017995, bei 100° C. 0,00018305; der mittlere Ausdehnungscoefficient für diese Temperaturdifferenz ist also 0,00018153. Es siedet bei 360° u. bildet einen farblosen Dampf von 6,976 specifischem Gewicht, welcher sich beim Abkühlen wieder zu flüssigem Q. condensirt. Schon bei 40° C. verdampft das Q. in merkbarer Menge u. selbst bei gewöhnlicher Temperatur verflüchtigt es sich. Die Quecksilberdämpfe wirken höchst giftig; sie verursachen Speichelfluß, nach längerem Einathmen ein eigenthümliches Zittern der Glieder, oft selbst den Tod. Die Leichtigkeit, mit welcher das Q. destillirt, hängt wesentlich von seiner Reinheit ab; nach Millon destillirt in derselben Zeit von reinem Q. dreizehn Mal mehr als von Q., welches 1/10000 Blei enthält; Zinn ist ohne Wirkung; Platin erhöht die Schnelligkeit der Destillation, wenn man es einige Tage mit dem Q. bei 50–80° C. in Berührung gelassen hat; das Q. hat alsdann auch die Eigenschaft erhalten, beim Schütteln zu schäumen. Bei ungefähr – 40° C. wird das Q. fest u. ist dann geschmeidig wie Blei; es läßt sich hämmern u. schneiden u. erzeugt auf der Haut Blasen wie heißes Eisen. Das Gefrieren des Q. ist am leichtesten zu bewerkstelligen, wenn man das Metall mit einem Gemenge von fester Kohlensäure u. Äther zusammenbringt; wirst man das feste Q. in Wasser, so gefriert dieses schnell, während das Q. flüssig wird. Nach Faraday's Versuch, Q. in einem glühenden Platintiegel zum Gefrieren zu bringen, erhitzt man den Tiegel bis zum Glühen, bringt darauf Äther u. dann feste Kohlensäure; sodann taucht man in die sich drehende Masse ein Platinschälchen mit ungefähr 2 Loth Q., welches binnen 2 bis 3 Secunden erstarrt. Diese Erscheinung findet ihre Erklärung im Leidensorstschen Phänomen, u. durch die beim Verdunsten des Gemenges von Äther u. Kohlensäure erzeugte Kälte, welche das Gefrieren des Q-s veranlaßt. Das feste Q. krystallisirt in regulären Oktaedern u. Nadeln; sein specifisches Gewicht ist 14,391. Reines Q. oxydirt sich nicht an der Luft; dagegen überzieht sich das käufliche, mit leicht oxydirbaren Metallen verunreinigte Q. bald mit einem dünnen Oxydhäutchen. Wird das Q. bis nahe zu seinem Siedpunkt erhitzt, so absorbirt es Sauerstoff u. bildet rothes. Quecksilberoxyd; mit Chlor verbindet es sich schon bei gewöhnlicher Temperatur; kochende Salzsäure u. verdünnte Schwefelsäure greifen es nicht an, verdünnte Salpetersäure löst es auf. Das Q. kann durch Schütteln, namentlich mit fremden Körpern, in ein seines graues Pulver verwandelt werden (Tödten des Q-s). Zur Darstellung dieses Quecksilberpulvers schüttelt man das Metall mit Essigsäure (Böttger) od. mit verschiedenen Salzlösungen, wie Chlorcallum, Salmiak, Salpeter (Millon). Auch durch Fällen aus einer Quecksilberauflösung erhält man das Q. in Form eines sehr zarten Pulvers; man vermischt eine Lösung von Zinnsalz in verdünnter Salzsäure mit einer heißen wässerigen Lösung von Quecksilbersublimat unter Umrühren u. wäscht den Niederschlag mit heißem Wasser aus; die Zersetzung erfolgt so, daß das Zinnchlorür dem Sublimat das Chlor entzieht u. in Zinnchlorid übergeht: SnCl + HgCl = SnCl2 + Hg.
Vorkommen u. Gewinnung des Q-s. Das Q. gehört zu den weniger häufig vorkommenden Metallen; es findet sich, jedoch seltener, gediegen als Jungfernquecksilber in Tröpfchen eingesprengt in den Quecksilbererzen. Das wichtigste Quecksilbererz ist der Zinnober (s.d.), welcher namentlich auf Lagern im Grauwackengebirge u. im Sandstein, im jüngeren Kalk des Übergangsgebirges u. im Rothliegenden, seltener auf Gängen in Begleitung von Schwefelkies u. Eisenspath vorkommt. Quecksilberlebererz u. Stahlerz sind von Zinnober durchdrungene bituminöse Mergel; Ziegelerz, von Zinnober durchdrungener Schiefer od. Sandstein; Korallenerz sind Schieferknoten mit Zinnober innig durchzogen; Branderz ist milder, erzführender Schiefer mit viel Bitumen; außerdem finden sich noch einige sehr seltene Quecksilbererze, wie Amalgam (aus Silber u. Q.), Quecksilberhornerz (Quecksilberchlorür) u. Selenquecksilber. Die wichtigsten Quecksilberbergwerke[748] sind zu Idria in Illyrien u. Almadén in Spanien, außerdem zu Horzowitz in Böhmen, Landsberg in Rheinbaiern, in Peru, Neu-Almadén in Californien, Mexico, China. Die bei weitem größte Menge des in den Handel kommenden Q-s wird aus dem Zinnober gewonnen, die durch Reinigung des Jungfernquecksilbers erhaltene Menge ist sehr gering. In Idria u. Almadén erhitzt man die Erze für sich in Öfen unter Luftzutritt, wobei der Schwefel zu schwefeliger Säure verbrennt u. das Q. verdampft; letzteres wird dann in geeigneten Condensationsräumen gesammelt; in Rheinbaiern wird der Zinnober mit Kalk erhitzt, wobei Schwefelcalcium u. schwefelsaurer Kalk gebildet werden; statt des Kalks wendet man auch Eisenhammerschlag an, welcher sich mit einem Theil des Schwefels zu Schwefeleisen verbindet, während ein anderer Theil Schwefel zu schwefeliger Säure verbrennt. Die älteren Quecksilberösen von Idria bestehen aus Schachtöfen mit daranstoßenden Condensationskammern. Über dem Herd befinden sich in entsprechenden Abständen drei durchbrochene Gewölbe, auf welche die Erze geschüttet werden, die größeren Stücken auf das unterste, die kleineren auf das zweite Gewölbe, der Staub u. Abfall von früheren Arbeiten wird in Schalen auf das oberste Gewölbe gestellt. Der durch die Hitze sich entwickelnde Quecksilberdampf u. die schwefelige Säure treten durch einen Kanal in eine Reihe abwechselnd unten u. oben miteinander in Verbindung stehender Condensationskammern; das Q. verdichtet sich an den Wänden derselben u. fließt von der geneigten, aus Lehm gestampften Sohle in Rinnen nach dem Sammelreservoir. Diese Öfen sind neuerdings zum Theil durch Flammenösen ersetzt worden, in welchen die Erze mit der Flamme u. Luft in Berührung kommen; die Dämpfe gelangen zunächst in eine Vorkammer, von da werden sie durch zwei horizontale lange Röhren nach vier mit einander in Verbindung stehenden, zwei oberen u. zwei unteren, Kammern geleitet, aus denen sie durch zwei andere horizontale lange Röhren in den Schornstein gelangen. Ein kleiner Theil des Q. condensirt sich in den Kammern, bei weitem das meiste sammelt sich, mit Ruß u. Staub vermengt, in den Röhren, welche durch darauffließendes Wasser abgekühlt werden. Dieses Gemenge, die Stuppe, trocknet man auf Schüsseln u. zerreibt es auf geneigten hölzernen Bühnen, wobei der größte Theil des Q-s in Tropfen abfließt; der Rückstand, welcher noch beträchtliche Mengen Q. enthält, wird auf Schüsseln in den Vorkammern abgebrannt. Die in Almadén angewendeten Quecksilberösen unterscheiden sich von den vorigen namentlich durch eine eigenthümliche Condensationsvorrichtung; sie haben in einer gewissen Höhe über der Feuerung einen Rost, auf welchen die Erze geschüttet u. anfangs durch ein leichtes Holzfeuer, dann stärker, erhitzt werden. Die Dämpfe werden erst in kleine Kammern geleitet u. aus diesen in mehre Reihen (Schnüren) aneinander gelegter thönerner birnförmiger Vorlagen, sog. Aludeln, welche auf einer nach der Mitte zu geneigten Ebene, dem Aludelplan, liegen; aus den Aludeln gelangen die Dämpfe in eine Kammer u. ziehen endlich durch den Schornstein ab. Das meiste Q. condensirt sich in den Aludeln u. läuft durch die Fugen derselben auf den Aludelplan, von wo aus es durch eine Rinne nach dem Sammelbehälter geführt wird. In Rheinbaiern destillirt man den mit Kalk vermischten Zinnober aus eisernen Retorten, deren jede 1/2 Centner Erz faßt u. deren 30–50 in einem Ofen beisammen liegen. Das Q. destillirt in irdene, halb mit Wasser gefüllte Vorlagen. Das Q. wird in schmiedeeisernen Flaschen od. in zusammengeschlagenen Beuteln (Schlegel) von gegerbten Hammelfellen versendet. Aus China hat man das Q. in ausgehöhlten u. mit Harz verschlossenen Bambusstäben von 1 Fuß Länge u. 3 Zoll Dicke nach England gebracht. Das in dem Handel vorkommende Q. ist niemals vollkommen rein, es enthält namentlich größere od. geringere Mengen Blei, Wismuth, Zinn u. Kupfer, außerdem noch Staub u. Unreinigkeiten. Solche Verunreinigungen lassen sich schon an dem grauen Überzug erkennen, mit welchem das Q. bedeckt ist, sowie daran, daß die Tropfen nicht rund sind, langsam fließen u. auf weißem Papier gerollt einen schmutzigen Streifen (Schwanz) hinterlassen; beim Schütteln überzieht sich unreines Q. mit einer grauen Haut, welche sich an die Glaswand anhängt; auf diese Weise ist noch, 1/40000, Blei zu erkennen. Um das Q. von Staub u. Unreinigkeiten zu befreien, preßt man es durch Leder od. filtrirt es durch ein Filter, in dessen Spitze ein kleines Loch gestochen ist. Durch Destillation kann das Q. von fast allen beigemengten Metallen befreit werden (s. oben), doch geht stets etwas Wismuth u. Zinn mit über. Ein sehr reines Metall erhält man, wenn man käufliches Q. mehre Wochen lang mit englischer Schwefelsäure unter öfterem Umschütteln in Berührung läßt u. dann mit verdünnter Salpetersäure od. salpetersaurem Quecksilberoxydul digerirt. Oder man verreibt das Q. mit 1/60 einer Lösung von Eisenchlorid von 1,48 specifischem Gewicht, welche mit dem gleichen Gewicht Wasser verdünnt ist; das Q. vertheilt sich in seine Kügelchen, welche sich nach dem Auswaschen u. Trocknen wieder vereinigen. Durch Erhitzen von Quecksilberoxyd erhaltenes Q. ist stets oxydhaltig u. muß daher mit verdünnter Salpetersäure od. Salzsäure digerirt werden, um das Oxyd aufzulösen. Ein sehr reines Q. gewinnt man durch Kochen von reinem Quecksilberchlorid mit metallischem Eisen; vollkommen reines Q. wird durch Destillation von gleichen Theilen Zinnober u. gebrannten Kalk od. Eisenfeilspähnen erhalten. Das Q. wird zum Füllen von Thermometern u. Barometern benutzt, ferner zum Amalgamirproceß bei der Silbergewinnung, zum Belegen der Spiegel, zum Vergolden im Feuer, in chemischen Laboratorien zu Gasuntersuchungen u. ähnlichen Arbeiten, zur Bereitung des Zinnobers u. einer Reihe anderer Präparate, welche theils für technische Zwecke, theils als Arzneimittel verwendet werden. Das metallische Q. befindet sich in dem feinvertheilten Zustande in einer Anzahl officineller Präparate, welche durch Verreiben von Q. mit Fetten od. schleimigen Substanzen dargestellt werden. Durch Verreiben des Q-s mit Zucker erhält man den Mercurius saccharatus s. Aethiops saccharatus; mit Graphit den Aethiops graphiticus, mit Schwefelantimon den Aethiops antimonialis, mit Gummischleim den Mercurius gummosus, mit Fett die Quecksilbersalbe, Unguentum mercuriale s. hydrargyri cinereum. Das Q. war schon den Alten bekannt, Theophrast beschreibt seine Bereitung aus Zinnober (Χυτὸς ἄργυρος, d. i. gegossenes Silber), welcher in Spanien gefunden wurde, künstlich bereitet von einigen Orten in Ephesus kam[749] Das höchste Ansehen erhielt das Q. bei den Alchemisten, weil man durch dasselbe die Veredelung der anderen Metalle bewirken zu können hoffte.
Verbindungen des Q-s. A) Mit Sauerstoff. Das Q. verbindet sich mit Sauerstoff in zwei Verhältnissen zu basischen Oxyden: a) Quecksilberoxydul, Hg2 O, ein schwarzes Pulver von 10,69 specifischem Gewicht, es ist wasserfrei, zerfällt bei der Einwirkung von Licht od. Wärme in Oxyd od. Q., bei stärkerer Erhitzung in Q. u. Sauerstoff. Man erhält es durch Zerlegung eines Quecksilberoxydulsalzes od. des Quecksilberchlorürs mit Kalilauge; der schwarze Niederschlag wird durch Decantiren mit Wasser ausgewaschen u. im Dunkeln bei gewöhnlicher Temperatur getrocknet. Das Quecksilberoxydul ist unlöslich in Wasser, löslich in heißer Essigsäure u. verdünnten Mineralsäuren, Säuren bilden mit ihm die Quecksilberoxydulsalze, welche durch Auflösen des Oxyduls in der betreffenden Säure erhalten werden; das salpetersaure Quecksilberoxydul gewinnt man auch durch Behandeln von Q. im Überschuß mit Salpetersäure od. durch Digestion von salpetersauerem Quecksilberoxyd mit metallischem Q. Die Lösungen der Quecksilberoxydulsalze werden durch Alkalien schwarz gefällt, durch kohlensaures Natron gelblich, beim Erhitzen schwarz, durch doppelkohlensaures Natron weiß; Schwefelwasserstoff u. Schwefelammonium fällen schwarzes Quecksilbersulphür, Salzsäure gibt einen Niederschlag von Quecksilberchlorür, enthält das Salz Oxyd, so geht Quecksilberchlorid in die Lösung über; metallisches Kupfer reducirt die Lösung; Zinnchlorür fällt anfangs weißes Chlorür, im Überschuß angewendet entsteht ein grauer Niederschlag von metallischem Q. b) Quecksilberoxyd, HgO, erscheint in zwei isomeren Modificationen, von denen die eine roth, die andere gelb ist. aa) Das rothe Oxyd (rothes Quecksilberoxyd, rothes Quecksilberpräcipität), a HgO, kann durch lange fortgesetztes Erhitzen von Q. in einem verschlossenen Gefäß bei einer dem Siedepunkt des Q-s nahe kommenden Temperatur in Form eines rothen krystallinischen Pulvers erhalten werden; so zubereitet war das Quecksilberoxyd früher als Mercurius praecipitatus per se officinell. Leichter bereitet man es durch Erhitzen von salpetersauerem Quecksilberoxyd od. Quecksilberoxydul für sich od. mit so viel metallischem Q., als in dem Salze enthalten ist, bis keine rothen Dämpfe von salpeteriger Säure mehr entweichen; im ersten Falle bildet das Oxyd schön rothe krystallinische Schuppen von 11,2 specifischem Gewicht, welche beim Zerreiben ein röthlichgelbes Pulvergeben; als solches erhält man das Oxyd beim Erhitzen des salpetersaueren Salzes mit Q. bb) Das gelbe Oxyd, b HgO, welches früher irrigerweise für Oxydhydrat gehalten wurde, fällt als Niederschlag beim Vermischen einer Lösung von salpetersaueren Quecksilberoxyd od. von Quecksilberchlorid mit Kalilauge im Überschuß. Beide Oxyde verhalten sich verschieden gegen Chlor, Oxalsäure u. Quecksilberchlorid. Läßt man Chlor auf trockenes Quecksilberoxyd einwirken, so oxydirt sich dasselbe zu unterchloriger Säure; doch ist hierbei die Beschaffenheit des Quecksilberoxyds von großem Einfluß. Rothes Oxyd veranlaßt nur die Bildung einer geringen Menge unterchloriger Säure, auf gelbes Oxyd ist dagegen die Einwirkung so heftig, daß bedeutende Erhitzung u. selbst Lichtentwickelung auftritt; wobei sich das gebildete unterchlorigsauere Gas wieder zersetzt; kühlt man aber das Oxyd ab, so erhält man reine, sauerstofffreie unterchlorige Säure. Das gelbe Oxyd wird durch eine Auflösung von Oxalsäure in der Kälte fast augenblicklich in weißes oxalsaueres Salz verwandelt, während das rothe Oxyd damit erhitzt werden kann, ohne aufgelöst zu werden. Wenn man das gelbe Oxyd mit einer weingeistigen Lösung von Quecksilberchloryd erhitzt, so verwandelt es sich in schwarzes Oxychlorid, während das rothe Oxyd sich nicht verändert. In den meisten übrigen Eigenschaften zeigen die beiden Oxyde keine Unterschiede, sie geben aber Verbindungen, welche bei gleicher Zusammensetzung abweichende Eigenschaften besitzen. Das Quecksilberoxyd wird beim Erwärmen dunkel, fast schwarz, erhält aber seine Farbe beim Erkalten wieder; in höherer Temperatur zerfällt es in Q. u. Sauerstoff; es ist wahrscheinlich, daß das gelbe Oxyd vor der Zersetzung in rothes übergeht. Am Lichte zerfällt das Quecksilberoxyd ebenfalls in Q. u. Sauerstoff, es wirkt auf oxydirbare Körper beim Erhitzen oxydirend, manche organische Stoffe werden sogar in wässeriger Lösung beim Kochen mit Quecksilberoxyd oxydirt. In Wasser ist das Quecksilberoxyd etwas löslich u. wirkt ätzend giftig. Mit Säuren bildet das Quecksilberoxyd basische, neutrale u. sauere Quecksilberoxydsalze, die neutralen sind farblos u. werden in Berührung mit Wasser in sauere lösliche u. basische unlösliche zerlegt; die letzteren sind gelb. Die Quecksilberoxydsalze sind giftig, die löslichen geben folgende Reactionen: Ätzkali u. Ätznatron geben einen gelben Niederschlag von Quecksilberoxyd, Ammoniak u. kohlensaures Ammoniak fällen weiße basische Doppelsalze, Schwefelwasserstoff gibt, in geringer Menge zugesetzt, weiße Niederschläge, Verbindungen von Schwefelquecksilber mit unzersetztem Quecksilbersalz, sogenannte schwefelbasische Salze, z.B.: 3HgCl + 2HS = HgCl, 2HgS + 2HCl; im Überschuß angewendet gibt Schwefelwasserstoff, sowie auch Schwefelammonium, schwarze Niederschläge von Schwefelquecksilber; gelbes Blutlaugensalz fällt weißes, gallertartiges Ferrocyanquecksilber, welches nach längerem Stehen blau wird; rothes Blutlaugensalz gibt einen gelben Niederschlag. Jodkalium fällt Jodquecksilber als schön scharlachrothen Niederschlag; Zinnchlorür fällt Anfangs weißes basisches Salz, dann metallisches Q. Salzsäure, sowie Chlorkalium u. Chlornatrium fällen Quecksilberoxydsalzlösungen nicht. Metallisches Kupfer überzieht sich in der Lösung eines Quecksilberoxydsalzes mit metallischem Q.
B) Mit Chlor verbindet sich das Q. schon beim Erhitzen in Chlorgas u. bildet damit zwei Verbindungen: a) Quecksilberchlorür, Hg2 Cl, so v.w. Kalomel, s.d.; b) Quecksilberchlorid (ätzendes Quecksilbersublimat, Sublimat, Mercurius sublimatus corrosivus, Hydrargyrum muriaticum corrosivum), eine durchsichtige krystallinische Masse, die sich sublimiren läßt u. dabei in Krystallen erhalten werden kann; aus Lösungen krystallisirt es leicht in langen dünnen prismatischen Krystallen, welche verschieden von den durch Sublimation gewonnenen sind, aber demselben System angehören; sehr schöne Krystalle schießen aus einer Lösung des Chlorids in einer Auflösung von Zinkquecksilberchlorid an. Es schmilzt bei etwa 265° C, siedet bei 293° C, löst sich bei 0° in 17,4 Theilen, bei 100° in 1,8 Theilen Wasser auf; in Alkohol u. Äther ist es leicht löslich. Es[750] wirkt höchst giftig. Man gewinnt es durch Auflösen von Quecksilberoxyd in Salzsäure u. Abdampfen zur Krystallisation, od. durch Auflösen von Q. in heißer Salzsäure unter Zusatz von Salpetersäure u. Abdampfen. Q. in einem Strom von Chlor erhitzt verbrennt mit weißer Flamme zu Quecksilberchlorid. Fabrikmäßig gewinnt man es durch Sublimation eines Gemenges von gleichen Theilen schwefelsaurem Quecksilberoxyd u. Kochsalz in weithalsigen Retorten; es bildet sich Sublimat u. schwefelsaures Natron. Man benutzt das Quecksilberchlorid als Medicament, es dient zur Bereitung verschiedener Quecksilberpräparate, ferner zum Ätzen des Stahls, in der Kattundruckerei als Reservage u. ist von Kyan zur Conservirung des Holzes (s. Holzconservirung) empfohlen worden (Kyanisiren des Holzes). Verbindungen des Quecksilberchlorids: aa) Mit anderen Chloriden verbindet sich das Quecksilberchlorid zu Doppelchloriden, sogenannte Chlorohydrargyraten, in denen es die Rolle einer Säure spielt; die wichtigsten dieser Doppelverbindungen sind: Ammoniumquecksilberchlorid, existirt in mehren Verhältnissen; das schon längst unter dem Namen Alembrothsalz (Sal Alembroth, Salz der Weisheit) = Am Cl, Hg Cl + HO, wird durch Auflösen von 1 Theil Salmiak u. 2 Theilen Quecksilberchlorid in Wasser u. Abdampfen der Mischung erhalten; es krystallisirt in rhombischen Prismen u. verliert in trockner Luft das Wasser, ohne seine Gestalt zu verändern. Bariumquecksilberchlorid, BaCl, 2HgCl + 2HO, Calciumquecksilberchlorid, aus einer gesättigten Lösung von Quecksilberchlorid in Chlorcalcium scheiden sich schöne luftbeständige Krystalle von der Zusammensetzung CaCl, 5HgCl + 8HO ab; aus der Mutterlauge krystallisiren große zerfließliche Prismen von der Formel CaCl, 2HgCl + 6HO. Kaliumquecksilberchlorid, KCl, HgCl + HO krystallisirt aus einer bei 30° gesättigten Lösung von Quecksilberchlorid in einer Auflösung von Chlorkalium, wenn man der Flüssigkeit nachher noch so viel Chlorkalium zusetzt, als angewendet worden war; verdampft man die Lösung ohne Zusatz von Chlorkalium, so erhält man Nadeln von der Zusammensetzung KCl, 2HgCl + 2HO. Magnesiumquecksilberchlorid, MgCl, 3HgCl + 5HO u. MgCl, HgCl + 6HO, zerfließliche Salze. Natriumquecksilberchlorid, NaCl, 2 HgCl + 4 HO, krystallisirt in schönen sechsseitigen Prismen. Manganchlorür, Eisenchlorür u. Chlorzink geben mit Quecksilberchlorid isomorphe Salze von der Zusammensetzung RCl, HgCl + 4HO. bb) Mit Sauerstoffsalzen verbindet sich das Quecksilberchlorid ebenfalls zu Doppelsalzen, so mit schwefeligsaurem Ammoniak, 2 (AmO, SO2) + 3HgCl, krystallisirt in perlmutterglänzenden Blättchen; ferner mit essigsaurem Kupferoxyd, mit chromsaurem Kali; die Verbindung mit letzterem Salz krystallisirt aus den Auflösungen von gleichen Äquivalenten Quecksilberchlorid u. doppelt chromsaurem Kali in rothen, harten Krystallen von der Zusammensetzung HgCl + KO, 2Cr Os; eine andere Verbindung erhält man in blaßrothen Krystallen, welche nach der Formel 2HgCl + KOCrO3 zusammengesetzt sind. Man kann diese Salze betrachten als zusammengesetzt aus: (HgO, 2CrO3+KO, 2CrO3) + (HgCl, KCl) u. (HgO, CrO3 + KOCrO3) + (3HgCl, KCl). Die Verbindungen von Quecksilberchlorid mit chromsaurem Ammoniak sind: Hg Cl+AmO, 2 CrO3 + HO, krystallisirt in großen rothen sechsseitigen Prismen, u. HgCl + 3 (AmO, 2CrO3), welches aus der Mutterlauge des ersteren Salzes krystallisirt. cc) Mit Quecksilberoxyd verbindet sich das Quecksilberchlorid in verschiedenen Verhältnissen zu den Basischen Quecksilberchloriden (Quecksilberoxychloriden); dieselben entstehen z.B. bei der Einwirkung von Quecksilberoxyd auf Sublimatlösung od. bei unvollständiger Fällung von Sublimatlösung durch Kali od. Natron od. bei der Einwirkung von Chlor auf Quecksilberoxyd. Mehre dieser Oxychloride treten in verschiedenen Modificationen auf, je nachdem sie das gelbe od. das rothe Oxyd enthalten. Zur Darstellung der Verbindungen bedient man sich einer bei gewöhnlicher Temperatur gesättigten Lösung von doppelt kohlensaurem Kali, die völlig frei von einfach kohlensaurem Kali sein muß, da dieses Anfangs reines Oxyd fällt. Nach Roucher können sechs Verbindungen von Quecksilberoxyd mit Quecksilberchlorid erhalten werden, in denen das erstere zu dem letzteren in dem Verhältnisse steht von 1 : 1/2 : 2 : 3 : 4 : 5 : 6. Das Halbbasische Quecksilberchlorid, HgO, 2 HgCl, welches das gelbe Oxyd enthält, fällt als gelblichweißer Niederschlag aus einer Quecksilberchloridlösung. Die Verbindung HgO, HgCl ist nicht bekannt. Zweifach basisches Quecksilberchlorid (Quecksilberbioxychlorid), 2 HgO, HgCl, in welchem das gelbe Oxyd enthalten ist, wird gewonnen, wenn man eine Lösung des doppelt kohlensauren Kalis mit dem 6–10fachen Volumen Sublimatlösung vermischt, umrührt u. den Niederschlag sogleich filtrirt; es ist ein ziegelrothes, nicht krystallinisches Pulver. Dasselbe Oxychlorid erhält man auch als einen Anfangs gelben, dann lebhaft rothen Niederschlag beim Fällen von 3 bis 4 Vol. Sublimatlösung mit 1 Vol. der Lösung von doppeltkohlensaurem Kali. Die Verbindung mit dem rothen Oxyd entsteht durch anhaltendes Sieden von Quecksilberoxyd mit überschüssigem Sublimat auch durch Fällen von Sublimatlösung mit doppelt kohlensauerem Kali unter beständigem Reiben; es krystallisirt in schwarzen Blättchen. Dreifach basisches Quecksilberchlorid (Quecksilberteroxychlorid), mit dem gelben Oxyd, scheidet sich in goldglänzenden, dem Musivgold ähnlichen Schuppen aus einer Mischung von Sublimatlösung mit dem gleichen Volumen doppelt kohlensaurem Kali aus. Dasselbe Oxychlorid erhält man amorph aus dem gelben Oxyd u. Sublimat in der Kälte. Vierfach basisches Quecksilberchlorid (Quecksilberquateroxychlorid), 4HgO, HgCl, setzt sich aus den Filtraten der vorigen Oxychloride ab, auch wenn man 1 Vol. Sublimatlösung mit 4 bis 6 Vol. Lösung von doppelt kohlensauerem Kali vermischt; die Verbindung scheidet sich nach u. nach an der Oberfläche als braune Krystallkruste ab. Fünffach basisches Quecksilberchlorid, 5HgO, HgCl, erhält man in schwarzbraunen Nadeln krystallisirt durch langsame Einwirkung von Quecksilberchlorid auf überschüssiges rothes Oxyd in der Kälte; auf gleiche Weise bildet sich das Sechsfach basische Quecksilberchlorid, 6HgO, HgCl. Auch eine Verbindung 6HgO, HgCl + HO ist bekannt. dd) Mit Schwefelquecksilber (Quecksilberchlorosulsuret), 2HgS, Hg Cl, durch Einleiten[751] von Schwefelwasserstoff in eine Sublimatlösung od. Digeriren von frischgefälltem Schwefelquecksilber mit Sublimatlösung erhalten, ein weißer Niederschlag, welcher durch fortgesetztes Einleiten von Schwefelwasserstoff in schwarzes Schwefelquecksilber übergeht. Auf trockenem Wege durch Erhitzen von Schwefelquecksilber mit Quecksilberchlorid in verschlossenen Röhren als weißliches krystallinisches Pulver gewonnen; ähnlich das Quecksilberchloroseleniet, 2 Hg Se, Hg Cl. ee) Mit Phosphorquecksilber. Durch Einleiten von Phosphorwasserstoff in Sublimatlösung erhält man einen Anfangs schwärzlichen, dann aber gelben Niederschlag von Quecksilberchlorophosphoret, Hg3 P, 3 Hg Cl. Über Schwefelsäure getrocknet enthält die Verbindung 3 Äquivalente Wasser; sie zerfällt beim Kochen mit Wasser in Q., Salzsäure u. phosphorige Säure. ff) Mit Arsenquecksilber. Arsenwasserstoff gibt mit Sublimatlösung einen braungelben Niederschlag von Quecksilberchlorarseniet, Hg3 As, 3 Hg Cl; beim Erhitzen von 3 Theilen Kalomel mit 1 Theil metallischen Arsenik sublimirt die Verbindung Hg As, Hg Cl in hellgelben Krystallen. gg) Mit Quecksilberamid. Quecksilberchlorid-Quecksilberamid (Weißer Präcipitat, Hydrargyrum amidato-bichloratum), Hg Cl + Hg NH2, ein weißes Pulver von widerlich scharf metallischem Geschmack, ist giftig, nicht in Weingeist, wenig in Wasser löslich, welches letztere beim Kochen od. längerem Auswaschen Salmiak entzieht u. eine basische, gelbe Verbindung hinterläßt. Man erhält es durch Fällen einer Lösung von 1 Theil Salmiak u. 2 Theilen Sublimat in Wasser mit kohlensaurem Kali; krystallirt wird es erhalten, wenn man zu einer kochenden Salmiaklösung Ammoniakflüssigkeit setzt u. so lange Sublimatlösung zugibt, als der Anfangs entstehende Niederschlag wieder aufgelöst wird; beim Erkalten schießen kleine Krystalle an. Auch beim Fällen einer concentrirten Sublimatlösung mit Ätzammoniak wird die Verbindung erhalten. Die rationelle Formel des weißen Präcipitats ist wahrscheinlich Hg Cl + N {H, H, Hg.
C) Mit Brom: a) Quecksilberbromür, Hg2 Br, dem Kalomel ähnliche Verbindung, ist in Wasser u. verdünnten Säuren unlöslich, wird durch Fällen einer Quecksilberoxydullösung mit Bromkalium od. durch Sublimiren von gleichen Äquivalenten Quecksilberbromid u. Q. erhalten. b) Quecksilberbromid, Hg Br, kann wie das Chlorid gewonnen werden, am leichtesten durch directe Vereinigung von Q. u. Brom bei Gegenwart von Wasser. Es löst sich in Wasser u. Alkohol, krystallisirt in farblosen glänzenden Blättchen od. Nadeln, schmilzt beim Erhitzen u. sublimirt dann. Analog dem Quecksilberchlorid verbindet es sich mit anderen Bromiden zu Doppelbromiden. Mit Quecksilberoxyd bildet es Basisches Quecksilberbromid (Quecksilberoxybromid), gelbes krystallinisches Pulver, entsteht beim Kochen von Quecksilberbromid mit Ouecksilberoxyd; 3 Hg O, Hg Br, ein braunes Pulver, beim Behandeln von Quecksilberbromidlösung mit kohlensaurem Natron erhalten. Quecksilberbromosulfuret, 2 Hg S, Hg Br, gelblicher Niederschlag, entsteht Anfangs beim Fällen von Quecksilberbromid durch Schwefelwasserstoff.
D) Mit Jod: a) Quecksilberiodur, Hg2 I, ein gelbgrünes Pulver, in Wasser sehr wenig, in Alkohol nicht löslich, zerlegt sich leicht in Q. u. Quecksilberiodid od. Quecksilberjodid-Jodür, bildet sich beim Zusammenreiben von Q. u. Jod, od. von Quecksilberjodid mit Q., wobei man die Masse mit Weingeist benetzt. Um es von Jodid zu befreien, behandelt man es mit Weingeist. Es ist als Hydrargyrum iodatum flavum s. Jodetum hydrargyrosum officinell. b) Quecksilberiodüriodid, Hg2 I + 2 Hg I, entsteht durch Fällen einer Lösung von salpetersauerem Quecksilberoxydul mit Jodkalium, zu welchem 1/2 Äquivalent Jod gesetzt worden ist, ein gelber Niederschlag, welcher unlöslich ist in Wasser u. Alkohol; beim Erhitzen wird es roth, schmilzt dann u. läßt sich ohne Zersetzung sublimiren. Die sublimirten Krystalle sind in der Hitze roth, werden aber beim Erkalten gelb. Dieselbe Verbindung erhält man leicht durch Zusammenreiben von Quecksilberjodid mit 1/2 Äquivalent Q. c) Quecksilberjodid, Hg I, ein prächtig scharlachrothes Pulver, wird durch Fällen einer Sublimatlösung mit Jodkalium od. Jodeisen erhalten, wobei jedoch ein Überschuß des Fällungsmittels, sowie des Quecksilbersalzes zu vermeiden ist, weil sich der Niederschlag im Jodkalium leicht auflöst, ein Überschuß von Sublimat aber ein chloridhaltiges Präparat liefert. Es ist in Wasser nur wenig, in Alkohol, bes. in heißem, auch in Äther u. fetten Ölen löslich; aus einer heiß bereiteten Auflösung von Jodkalium krystallisirt es beim langsamen Erkalten in prächtig rothen Krystallen. Bei mäßigem Erhitzen geht die rothe Farbe in Gelb über, bei höherer Temperatur schmilzt es, siedet u. sublimirt in tafelförmigen Platten von schön gelber Farbe. Die Form der rothen Krystalle ist wesentlich verschieden von der der gelben, das Quecksilberjodid ist also dimorph. Die durch Sublimation erhaltenen gelben Krystalle werden von selbst nach einiger Zeit roth, sogleich erfolgt diese Umwandlung beim Zerdrücken, Zerreiben od. Ritzen, zuweilen schon beim Erkalten. Das Quecksilberjodid ist als Hydrargyrum biiodatum rubrum officinell. Mit Jodmetallen verbindet sich das Quecksilberjodid zu den Doppelchloriden analogen aa) Doppeljodiden (Jodohydrargyraten), ebenso mit anderen Quecksilberverbindungen. Kaliumquecksilberiodid, K I, 2 Hg I + 3 HO, krystallisirt aus einer concentrirten Auflösung von Jodkalium, in welcher 3 Äquivalente Quecksilberjodid aufgelöst sind, in langen gelben Prismen, die in Alkohol u. Äther löslich sind, in der Hitze Wasser geben u. zu einer rothen Flüssigkeit von Quecksilberjodid schmelzen; Wasser scheidet die Hälfte Quecksilberjodid aus, die Lösung gibt Krystalle der Verbindung K I, Hg I. Natriumquecksilberjodid, gelbe, nicht krystallinische Masse, welche durch Reiben roth wird, indem sich Quecksilberjodid ausscheidet. Ammoniumquecksilberiodid, Am I, 2 Hg I + 3 HO, gelbe Nadeln, sublimirbar. bb) Quecksilberoxyiodid (Basisches Quecksilberjodid), 3 Hg O, Hg I, ein gelbbraunes Pulver, entsteht beim Digeriren von Quecksilberjodid mit verdünnter Kalilauge. cc) Quecksilberchloriodid, Hg I, 2 Hg Cl, farblose Krystalle, scheiden sich aus einer heißen Lösung von Quecksilberjodid in Quecksilberchlorid aus. dd) Quecksilberiodsulfuret, Hg I, 2 Hg S, entsteht als gelbes Pulver, wenn man Quecksilberjodid mit einer zur vollständigen Zersetzung nicht hinreichenden Menge von Schwefelwasserstoffwasser digerirt.
[752] E) Mit Stickstoff: Stickstoffquecksilber.
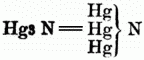
(Trimercuramin). Beim Erhitzen des weißen Präcipitats bleibt ein rother, dem Quecksilberoxyd ähnlicher Rückstand, welcher von Mitscherlich als eine Verbindung von Quecksilberchlorid mit Stickstoffquecksilber (2 Hg Cl + Hg3 N) erkannt wurde. Im isolirten Zustande ist das Stickstoffquecksilber von Plantamour dargestellt worden, indem er trockenes Ammoniakgas in der Kälte über gefälltes Quecksilberoxyd leitete. Es ist ein braunes Pulver, welches unter Feuererscheinung stark explodirt, wie Jodstickstoff, doch nicht so leicht wie dieser; läßt man es auf einem Eisenblech durch Erhitzen explodiren, so entsteht eine Vertiefung od. ein Loch. Mit concentrirter Schwefelsäure explodirt es, concentrirte Salpetersäure gibt salpetersaures Ammoniak u. salpetersaures Quecksilberoxyd, Salzsäure gibt Quecksilberchlorid u. Salmiak. Mit Ätzkali erhitzt liefert es Ammoniak u. Q.; concentrirte Kalilauge verwandelt es in ein gelbes Pulver. Das Stickstoffquecksilber kann betrachtet werden als Ammoniak, in welchem 3 Äquivalente Wasserstoff durch Q. vertreten sind.
F) Mit Schwefel: a) Quecksilbersubsulfuret (Halbschwefelquecksilber), Hg2 S, wird als schwarzer Niederschlag beim Fällen von Quecksilberoxydulsalzen mit Schwefelwasserstoff erhalten; am besten ist es, eine verdünnte Auflösung von salpetersaurem Quecksilberoxydul in eine verdünnte Lösung von Schwefelammonium zu tröpfeln; beim Erhitzen zerfällt es in Einfach-Schwefelquecksilber u. Q. b) Quecksilbersulfuret (Einfach Schwefelquecksilber), Hg S, bildet im amorphen Zustande ein schwarzes Pulver, krystallisirt ist es roth u. stellt den Zinnober (s.d.) dar. Das schwarze Schwefelquecksilber wird durch directe Vereinigung von Q. u. Schwefel in dem erforderlichen Verhältniß, sowie durch Fällen einer Quecksilberoxydlösung mit Schwefelwasserstoff erhalten, es ist ein sammetschwarzes Pulver, welches bei Abschluß der Luft erhitzt sublimirt u. dabei in Zinnober übergeht. Verdünnte Säuren lösen es nicht auf, concentrirte Salpetersäure od. Königswasser zersetzen es. Es löst sich in einer concentrirten Lösung von Schwefelkalium; beim Verdampfen der Flüssigkeit erhält man farblose Nadeln der Verbindung: K S, Hg S + 5 HO. Der als Medicament benutzte Aethiops mineralis ist ein Gemisch von schwarzem Schwefelquecksilber mit Schwefel; man gewinnt es durch Zusammenreiben von gleichen Theilen Q. u. Schwefel.
G) Mit Selen: Selenquecksilber, Hg Se, findet sich in der Natur, wird künstlich erhalten durch directe Vereinigung von Q. u. Selen; es sublimirt beim Erhitzen zu einer grauen metallglänzenden krystallinischen Masse.
H) Mit Phosphor verbindet sich das Q. beim Digeriren von Quecksilberoxyd mit Phosphor; das Phosphorquecksilber ist schwarz od. braun, zerlegt sich beim Erhitzen.
I) Mit Fluor: a) Quecksilberfluorür, Hg2 Fl, entsteht beim Eintragen von wässriger Flußsäure in kohlensaures Quecksilberoxydul, auch beim Vermischen einer Lösung von Fluorsilber mit Quecksilberchlorür. Es kann bis 200° C. ohne Zersetzung erhitzt werden, in höherer Temperatur sublimirt Q. u. das Glas wird stark angegriffen; Wasser zersetzt es u. scheidet Quecksilberoxydul aus; b) Quecksilberfluorid, Hg Fl, krystallisirt aus einer Lösung von Quecksilberoxyd in wässriger Flußsäure in farblosen Nadeln; Wasser zerlegt es unter Bildung von röthlichgelbem Quecksilberoxyfluorid, Hg O, Hg Fl + HO. Kieselquecksilberfluorür, 3 Hg2 Fl, 2 Si Fl3 + 6 HO, wasserhelle Prismen, krystallisiren aus einer Auflösung von kohlensaurem Quecksilberoxydul in Kieselflußsäure. Quecksilberoxyd löst sich in Kieselflußsäure zu einem sauren Salz, aus der Lösung erhält man beim Verdampfen gebliche Krystalle von Kieselquecksilberfluorid, 3 Hg O, 3 Hg Fl, 2 Si Fl3 + 9 HO, welche durch Wasser zersetzt werden.
K) Mit Cyan: Quecksilbercyanid, Hg Cy, krystallisirt in weißen, undurchsichtigen Säulen aus einer Auflösung von Quecksilberoxyd in Blausäure; es löst sich in Wasser, wenig in Alkohol, schmeckt bitter u. metallisch, ist höchst giftig; man benutzt es zur Darstellung des Cyangases. Quecksilberoxycyanid, Hg Cy, Hg O, entsteht als weiße Nadeln, wenn man Quecksilberoxyd in einer siedenden Lösung von Quecksilbercyanid löst u. die Lösung erkalten läßt. Quecksilberchlorocyanid, Hg Cy, Hg Cl, eine Auflösung gleicher Äquivalente von Quecksilberchlorid u. Quecksilbercyanid gibt beim Verdampfen luftbeständige Krystalle dieser Verbindung, Kaliumquecksilbercyanid, K Cy, Hg Cy, krystallisirt in luftbeständigen farblosen Octaëdern, welche sich in 41/2 Theilen kaltem Wasser lösen. Chlorammoniumquecksilbercyanid, NH4 Cy, 2Hg Cy, krystallisirt in langen seidenglänzenden Nadeln. Bunsen hat endlich ein interessantes Salz von der Formel Hg2 Fe Cy3 NH4 O, dargestellt.
L) Mit Rhodan: a) Quecksilberrhodanür, Hg2 C2NS2, entsteht beim Vermischen verdünnter Lösungen von salpetersaurem Quecksilberoxydul mit Rhodankalium; weißer Niederschlag, welcher von Säuren sehr wenig angegriffen, aber von Salzsäure u. Schwefelwasserstoff zersetzt wird. Beim Erhitzen gibt es Schwefelkohlenstoff, Cyan, Stickstoff, Q., Schwefelquecksilber u. hinterläßt Mellan. b) Quecksilberrhodanid, Hg C2 N S2, nadelförmige Krystalle, welche beim Verdunsten einer Auflösung von Quecksilberoxyd in Rhodanwasserstoffsäure erhalten werden, sie sind wasserhaltig u. geben beim Erhitzen sehr verschiedenartige Zersetzungsproducte. Quecksilberoxyrhodanid, Hg C2 N S2, 2 Hg O, wird als gelbes Pulver aus der Lösung von Kaliumquecksilberrhodanid durch Ammoniak gefällt. Kaliumquecksilberrhodanid, K Cs N S2, 2 Hg C2N S2, entsteht, wenn man Rhodankalium mit Quecksilberchlorür zusammenreibt; aus der von Quecksilberchlorür abfiltrirten Flüssigkeit scheidet es sich beim Erkalten in gelben Tafeln ab, welche sich, wenn sie aus Weingeist umkrystallisirt werden, in perlglänzende, weiße, strahlig gruppirte Nadeln verwandeln.
M) Durch die Einwirkung von Ammoniak auf Quecksilberverbindungen erhält man eine Reihe von Verbindungen, zu denen zunächst das schon oben erwähnte Stickstoffquecksilber gehört. Überzieht man Ouecksilberoxyd mit Ammoniakflüssigkeit, so verwandelt es sich in einen gelben Körper, welcher als eine wasserhaltige Verbindung von Quecksilberoxyd mit Ammoniak betrachtet werden kann, aber wahrscheinlicher eine Verbindung von Quecksilberoxyd mit Quecksilberamid (3 Hg O + Hg H2 N) ist. Dieses Quecksilberamid (Mercuramin),[753] Hg H2 N, kann als Ammoniak betrachtet werden, in welchem 1 Äquivalent Wasserstoff durch 1 Äquivalent Q. ersetzt worden ist; diese Verbindung wird demnach den Platinbasen an die Seite zu stellen sein. Durch Fällen einer Sublimatlösung mit Ätzammoniak entsteht das Quecksilberchlorid-Quecksilberamid (Weißer Präcipitat), welches als eine Verbindung von Quecksilberchlorid
mit Mercuramin =
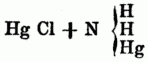
anzusehen ist. Behandelt man Quecksilberjodid mit Ammoniakgas, so entsteht eine weiße Masse von Quecksilberiodidammoniak, Hg I, N H3, welche an der Luft Ammoniak verliert u. roth wird. Quecksilberamidoxyiodid, Hg I, 2 Hg O, Hg N H2, ein braunes Pulver, welches bei wiederholter Behandlung des Quecksilberiodids mit siedender Ammoniakflüssigkeit zurückbleibt.
N) Die Verbindungendes Q-s mit andern Metallen werden Amalgame genannt. Mit vielen Metallen vereinigt sich das Q. in bestimmten Verhältnissen zu festen, zum Theil krystallisirbaren Verbindungen; diese festen Amalgame lösen sich gewöhnlich in einem Überschuß von Q. auf od. werden darin sein zertheilt, wodurch die flüssigen Amalgame entstehen. Die meisten Amalgame entstehen durch bloßes Zusammenbringen des betreffenden Metalles mit Q., einige Metalle verbinden sich nur indirect mit Q., wie Mangan, Kobalt, Nickel. a) Ammonium verbindet sich mit Q. zu einem Amalgam, in welchem der metallische Charakter des Ammoniums deutlich erkennbar ist. Man erhält das Ammoniumamalgam leicht, wenn man in ein Stück angefeuchteten Salmiak eine Höhlung macht, in dieseetwas Q. bringt u. das Salz auf ein mit dem positiven Pol einer galvanischen Batterie in Verbindung stehendes Platinblech legt, in das Q. aber den Platindraht des negativen Pols taucht. Das Q. schwillt an, wird dick wie Butter, ohne seinen Glanz zu verlieren u. verwandelt sich in Amalgam; die Verbindung wird beschleunigt, wenn das Q. etwas Kalium od. Natrium enthält. Das Ammoniumamalgam ist bei gewöhnlicher Temperatur weich, schaumig, metallglänzend u. leichter als Wasser; stark erkältet wird es starr, dunkelgrau u. auf dem Bruche fast schwarz. Sowie das Amalgam aus dem Kreise der Kette kommt, zerfällt es in Q., Ammoniak u. Wasserstoff. b) Blei verbindet sich sehr leicht mit Q., bes. wenn es geschmolzen angewendet wird, zu einem weißen, glänzenden Amalgam; ein Amalgam aus gleichen Theilen Q. u. Blei ist krystallisirbar. c) Eisen amalgamirt sich, wenn man Quecksilberdampf durch glühende eiserne Röhren streichen läßt; in der Kälte verbinden sich beide Metalle nicht, daher das Q. in eisernen Gefäßen versendet werden kann. d) Gold u. Q. vereinigen sich bei bloßer Berührung sehr leicht zu Goldamalgam; eine Spur von Quecksilberdampf reicht hin, das Gold weiß zu färben; durch Erhitzen kann das Q. wieder verflüchtigt u. die Farbe des Goldes hergestellt werden, sofern das Q. rein von anderen Metallen war. Das Goldamalgam dient bes. zur Feuervergoldung; es besteht, wenn es vorher durch Sämischleder gepreßt worden ist, aus 67 Gold u. 33 Q., das abgepreßte Q. enthält noch ziemlich viel Gold; das Q. muß rein von metallischen Beimengungen sein, weil diese beim Verflüchtigen des Q-s zurückbleiben u. die Farbe des Goldes verderben. e) Kadmium verbindet sich schon bei gewöhnlicher Temperatur mit Q. zu einem Amalgam aus 21,7 Kadmium u. 78,3 Q., dasselbe ist hart, schwerer als Q, krystallisirt u. schmilzt bei 75°. f) Kalium vereinigt sich mit Q. selbst bei überwiegender Menge des letzteren unter starker Erhitzung zu sprödem, festem Amalgam. g) Kupfer amalgamirt sich nur in Pulverform zu einer blaßrothen Legirung; Q. auf eine mit verdünnter Salpetersäure gereinigte Quecksilberoberfläche gerieben, haftet fest an dem Kupfer an u. bildet einen silberweißen Überzug. Französische Zahnärzte bedienen sich zum Plombiren der Zähne eines Amalgams aus 3 Theilen Kupfer u. 7 Theilen Q.; es hat die merkwürdige Eigenschaft, daß es bis zum Siedepunkt des Wassers erhitzt u. noch warm in einem Mörser gerieben, eine knetbare Masse bildet, welche nach 10–12 Stunden verhärtet, ohne ihr Volumen im Geringsten zu verändern; deshalb bleibt die Ausfüllung eines hohlen Zahnes nach dem Erhärten fest eingepreßt. Ein anderes zu demselben Zweck empfohlenes Amalgam besteht aus 2 Theilen Zinn, 1 Theil Kadmium u. der nöthigen Menge Q., es soll vor dem ersteren den Vorzug haben, daß es nicht, wie dieses, im Munde schwarz wird. h) Natrium verhält sich gegen Q. wie Kalium, s. oben e). i) Silber verbindet sich mit Q. bei gewöhnlicher Temperatur, wenn man Blattsilber od. gefälltes Silber mit Q. zusammenreibt, od. wenn man eine Auflösung von salpetersaurem Silberoxyd mit überschüssigem Q. zersetzt, wobei sich das Silber reducirt u. als sogenannter Silberbaum (Dianenbaum) anschließt, sich aber gleichzeitig mit dem überschüssigen Q. amalgamirt. Das Amalgam ist zinnweiß, krystallisirt im regulären System; es besteht aus 65 Q. u. 35 Silber u. wird zur Feuerversilberung angewendet. Die leichte Vereinigung des Silbers mit dem Q. hat man zur Gewinnung des Silbers aus seinen Erzen benutzt. In der Natur findet sich das Silberamalgam krystallisirt als sogenanntes Amalgam u. als Arquerit. k) Wismuth verbindet sich leicht mit Q.; ein Amalgam von 1 Wismuth u. 2 Q. krystallisirt beim langsamen Erkalten in Oktaedern; es ist dünnflüssig, daher setzt man Wismuth zu Amalgamen, um dieselben dünnflüssig zu machen; ein Amalgam von 1 Blei, 1 Wismuth u. 3 Q. ist so dünnflüssig, daß es durch Leder gepreßt werden kann; 1 Wismuth u. 4 Q. geben ein Amalgam zum Belegen von Glaskugeln; ein Amalgam von 10 Q., 171/2 Zinn, 31 Blei u. 50 Wismuth ist erst bei 60° fest, es wird zu anatomischen Ausspritzungen angewendet. Durch Zusammenschmelzen von 3 Theilen Zinn, 3 Theilen Wismuth u. einem Zusatz von 11/2 Theil Q. u. Zerreiben der Mischung erhält man das Musivsilber (unechtes Malersilber). Werden 28 Theile Wismuth, 118 Theile Zinn u. 201 Theil Blei in 1616 Theilen Q. bei +18° eingetragen, so erfolgt eine Abkühlung auf –10°. l) Zink verbindet sich in der Wärme mit Tl., eine Verbindung von 1 Theil Zink u. 2 Theilen Q. ist krystallisirbar; ein Amalgam von 1 Theil Zink u. 12 Theilen Q. benutzt man zur sogenannten falschen Vergoldung des Kupfers, zu welchem Zweck man das Kupfer mit dem Amalgam unter Zusatz von Weinstein u. Salzsäure kocht. m) Zinn u. Q. vereinigen sich leicht mit einander, bes. wenn ersteres geschmolzen angewendet wird. Ein Amalgam von 1 Theil Zinn u. 3 Theilen Q. krystallisirt in Würfeln. Man benutzt das[754] Zinnamalgam bes. zum Belegen der Spiegel. Kienmayers Amalgam für die Reibzeuge der Elektrisirmaschinen besteht aus 1 Theil Zinn, 1 Theil Zink u. 2 Theilen Q.
Pierer's Lexicon. 1857–1865.
